
Gassen eigenschappen, gedrag, vorm, voorbeelden

De gassen Het zijn al die stoffen of verbindingen waarvan de aggregatietoestand zwak en gedispergeerd is, terwijl ze tegelijkertijd sterk afhangen van de druk- en temperatuuromstandigheden die hen beheersen. Ze zijn misschien wel de tweede meest voorkomende vorm van materie in het hele universum, na plasma..
Op aarde vormen gassen de lagen van de atmosfeer, van de exosfeer tot de troposfeer en de lucht die we inademen. Hoewel een gas onzichtbaar is wanneer het door grote ruimtes, zoals de lucht, wordt verspreid, wordt het gedetecteerd door de beweging van wolken, de wendingen van de wieken van een molen, of door de dampen die in koude klimaten uit onze mond worden uitgeademd..

Evenzo, als we naar de negatieve milieuaspecten gaan, wordt het waargenomen in de zwarte rook van de uitlaatpijpen van de voertuigen, in de rookkolommen van de torens in de fabrieken, of in de rook die wordt opgewekt wanneer een bos brandt..
Je wordt ook geconfronteerd met gasvormige verschijnselen als je dampen ziet die uit de riolen komen, in de slierten van moerassen en begraafplaatsen, in het bubbelen in de aquariums, in de heliumballonnen die in de lucht vrijkomen, in de zuurstof die door planten wordt afgegeven. als resultaat van hun fotosynthese, en zelfs bij boeren en winderigheid.
Waar gassen worden waargenomen, betekent dat er een chemische reactie heeft plaatsgevonden, tenzij ze worden gefixeerd of rechtstreeks worden geassimileerd vanuit de lucht, de belangrijkste bron van gassen (oppervlakkig) op de planeet. Als de temperatuur stijgt, veranderen alle stoffen (chemische elementen) in gassen, inclusief metalen zoals ijzer, goud en zilver..
Ongeacht de chemische aard van gassen hebben ze allemaal de grote afstand gemeen die hun deeltjes scheidt (atomen, moleculen, ionen, enz.), Die chaotisch en willekeurig door een bepaald volume of een bepaalde ruimte bewegen..
Artikel index
- 1 Eigenschappen van gassen
- 1.1 Fysiek
- 1.2 Elektrische en thermische geleidbaarheid
- 1.3 Reactiviteit
- 2 Gedrag van gassen
- 3 Vorm van gassen
- 4 Druk van een gas
- 4.1 Eenheden
- 5 Volume van een gas
- 6 Belangrijkste gaswetten
- 6.1 De wet van Boyle
- 6.2 Charles Law
- 6.3 Wet van Gay-Lussac
- 6.4 De wet van Avogadro
- 7 soorten gassen
- 7.1 Brandbare gassen
- 7.2 Industriële gassen
- 7.3 Inerte gassen
- 8 Voorbeelden van gasvormige elementen en verbindingen
- 8.1 Gasvormige verbindingen
- 9 referenties
Eigenschappen van gassen
Fysiek
De fysische eigenschappen van gassen variëren afhankelijk van de stof of verbinding die erbij betrokken is. Gassen worden in de volksmond geassocieerd met slechte geuren of verrotting, hetzij vanwege hun zwavelgehalte, hetzij door de aanwezigheid van vluchtige aminen. Evenzo worden ze gevisualiseerd met groenachtige, bruine of gelige kleuren, die intimideren en een slecht voorteken geven.
De meeste gassen, of in ieder geval de meest voorkomende, zijn in feite kleurloos en geurloos. Hoewel ze ongrijpbaar zijn, kunnen ze op de huid worden gevoeld en zijn ze bestand tegen beweging, en vormen ze zelfs stroperige lagen op de lichamen die erdoorheen gaan (zoals gebeurt bij vliegtuigen)..
Alle gassen kunnen druk- of temperatuurveranderingen ondergaan die ze uiteindelijk in hun respectievelijke vloeistoffen veranderen; dat wil zeggen, ze lijden onder condensatie (als ze worden afgekoeld) of vloeibaar worden (als ze worden "geperst").

Aan de andere kant kunnen gassen oplossen in vloeistoffen en sommige poreuze vaste stoffen (zoals actieve kool). De bellen zijn het resultaat van opeenhopingen van gassen die nog niet zijn opgelost in het medium en ontsnappen naar het oppervlak van de vloeistof..
Elektrische en thermische geleidbaarheid
Onder normale omstandigheden (zonder ionisatie van hun deeltjes) zijn gassen slechte geleiders van warmte en elektriciteit. Wanneer ze echter worden gestrest met veel elektronen, laten ze stroom erdoorheen, zoals te zien is bij bliksem tijdens stormen..
Aan de andere kant, bij lage drukken en onderworpen aan een elektrisch veld, lichten sommige gassen, vooral de edele of perfecte, op en worden hun lichten gebruikt voor het ontwerp van advertenties en nachtposters (neonlicht), evenals in de beroemde elektrische ontladingslampen in straatlantaarns.
Met betrekking tot thermische geleidbaarheid gedragen veel gassen zich als thermische isolatoren, dus hun opname in de vulling van vezels, weefsels of glaspanelen helpt te voorkomen dat er warmte doorheen gaat en houdt de temperatuur constant..
Er zijn echter gassen die goede warmtegeleiders zijn en die ergere brandwonden kunnen veroorzaken dan die veroorzaakt door vloeistoffen of vaste stoffen; bijvoorbeeld zoals met hete stoom van gebakken cupcakes (of empanadas), of van stoomstralen die ontsnappen uit boilers.
Reactiviteit
Over het algemeen worden reacties waarbij gassen betrokken zijn, of waar ze voorkomen, geclassificeerd als gevaarlijk en omslachtig.
Hun reactiviteit hangt wederom af van hun chemische aard; Bij het gemakkelijk uitbreiden en mobiliseren moet echter meer zorg en controle worden betracht, omdat ze drastische drukverhogingen kunnen veroorzaken die de structuur van de reactor in gevaar brengen; om nog maar te zwijgen over hoe brandbaar of niet zalig gassen zijn.
Gedrag van gassen
Macroscopisch kan men een idee krijgen van het gedrag van gassen door te zien hoe rook, ringen of de literaire "tongen" van sigaretten in de lucht evolueren. Evenzo, wanneer een rookgranaat ontploft, is het interessant om de beweging van deze verschillende gekleurde wolken in detail te beschrijven.
Dergelijke waarnemingen zijn echter onderhevig aan de werking van de lucht, en ook aan het feit dat er zeer fijne vaste deeltjes in de rook zweven. Daarom zijn deze voorbeelden niet voldoende om tot een conclusie te komen over het werkelijke gedrag van een gas. In plaats daarvan zijn experimenten uitgevoerd en is de kinetische theorie van gassen ontwikkeld..
Moleculair en idealiter komen gasvormige deeltjes elastisch met elkaar in botsing, met lineaire, roterende en vibrerende verplaatsingen. Ze hebben een bijbehorende gemiddelde energie, waardoor ze vrij door elke ruimte kunnen reizen zonder bijna interactie of botsing met een ander deeltje naarmate het volume eromheen toeneemt..
Zijn gedrag zou een mengeling worden van de grillige Brownse beweging en de botsingen van enkele biljartballen die onophoudelijk tussen elkaar en de wanden van de tafel stuiteren; als er geen muren zijn, zullen ze naar het oneindige diffunderen, tenzij ze worden tegengehouden door een kracht: de zwaartekracht.
Vorm van gassen
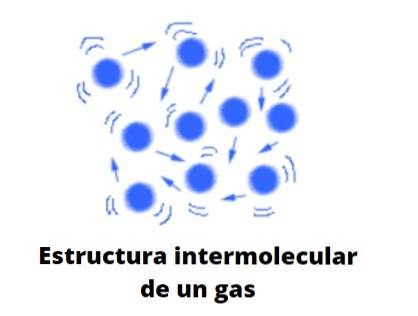
Gassen zijn, in tegenstelling tot vloeistoffen en vaste stoffen, niet van het gecondenseerde type; dat wil zeggen, de aggregatie of cohesie van zijn deeltjes slaagt er nooit in om een vorm te definiëren. Ze delen met vloeistoffen het feit dat ze het volume van de container waarin ze zich bevinden volledig innemen; ze missen echter oppervlakte- en oppervlaktespanning.
Als de gasconcentratie hoog is, zijn de "tongen" of de reeds beschreven macroscopische vormen met het blote oog te zien. Deze zullen vroeg of laat verdwijnen door de werking van de wind of door louter de expansie van het gas. De gassen bedekken dus alle hoeken van de beperkte ruimte, ontstaan uit zeer homogene systemen.
Nu beschouwt de theorie gassen gemakshalve als bollen die nauwelijks met zichzelf in botsing komen; maar als ze dat doen, stuiteren ze elastisch.
Deze bollen zijn ver van elkaar verwijderd, dus de gassen zijn praktisch "vol" vacuüm; vandaar de veelzijdigheid om door de kleinste spleet of spleet te gaan, en het gemak om ze aanzienlijk te kunnen comprimeren.
Daarom, hoe gesloten een bakkerij-installatie ook is, als je ernaast loopt, weet je zeker dat je zult genieten van de geur van vers gebakken brood..
Druk van een gas
Aangenomen zou kunnen worden dat omdat de bollen of deeltjes van het gas zo verspreid en gescheiden zijn, ze geen enkele druk op de lichamen of objecten kunnen uitoefenen. De atmosfeer bewijst echter dat zo'n overtuiging vals is: het heeft massa, gewicht en voorkomt dat vloeistoffen uit het niets verdampen of koken. Kookpunten worden gemeten bij atmosferische druk.
Gasdrukken worden beter kwantificeerbaar als manometers beschikbaar zijn of als ze zijn ingesloten in containers met niet-vervormbare wanden. Dus hoe meer gasdeeltjes er in de container zitten, hoe groter het aantal botsingen tussen hen en de wanden van de container..
Deze deeltjes, wanneer ze tegen de wanden botsen, drukken erop, omdat ze een kracht uitoefenen die evenredig is met hun kinetische energie op hun oppervlak. Het is alsof de ideale biljartballen tegen een muur worden gegooid; als er veel zijn die ze met hoge snelheid treffen, kan het zelfs breken.
Eenheden
Er zijn veel units die gasdrukmetingen begeleiden. Enkele van de bekendste zijn millimeters kwik (mmHg), zoals torr. Er zijn die van het internationale systeem van eenheden (SI) die de pascal (Pa) definiëren in termen van N / mtweeen van hem, de kilo (kPa), mega (MPa) en giga (GPa) pascal.
Volume van een gas
Een gas neemt het volume van de container in en zet uit. Hoe groter de container, het volume van het gas zal ook zijn; maar zowel de druk als de dichtheid zullen afnemen voor hetzelfde aantal deeltjes.
Aan de andere kant heeft het gas zelf een bijbehorend volume dat niet zozeer afhangt van de aard of moleculaire structuur (idealiter), maar van de druk- en temperatuurcondities die het beheersen; dit is het molaire volume.
In werkelijkheid varieert het molaire volume van gas tot gas, hoewel de variaties klein zijn als het geen grote en heterogene moleculen zijn. Het molaire volume van ammoniak (NH3, 22.079 L / mol) bij 0 ºC en 1 atm, verschilt van helium (He, 22.435 L / mol).
Alle gassen hebben een molair volume dat verandert als functie van P en T, en hoe groot hun deeltjes ook zijn, het aantal is altijd hetzelfde. Van hieruit heeft hij in feite afgeleid wat bekend staat onder het getal van Avogadro (NNAAR.
Belangrijkste gaswetten
Het gedrag van gassen wordt al eeuwen bestudeerd door middel van experimenten, diepgaande observaties en interpretatie van de resultaten..
Dergelijke experimenten maakten het mogelijk om een reeks wetten vast te stellen die, samen in dezelfde vergelijking (die van ideale gassen), helpen om de reacties van een gas op verschillende omstandigheden van druk en temperatuur te voorspellen. Op deze manier is er een relatie tussen het volume, de temperatuur en de druk, evenals het aantal mol in een bepaald systeem..
Onder deze wetten zijn de volgende vier: Boyle, Charles, Gay-Lussac en Avogadro's.
De wet van Boyle
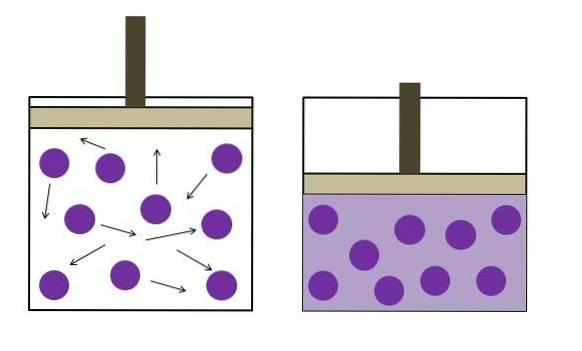
De wet van Boyle stelt dat bij constante temperatuur het volume van een ideaal gas omgekeerd evenredig is met zijn druk; dat wil zeggen, hoe groter de container, hoe lager de druk die de wanden zullen ervaren vanwege dezelfde hoeveelheid gas..
Charles Law

De wet van Charles stelt dat bij constante druk het volume van een ideaal gas recht evenredig is met de temperatuur. Ballonnen demonstreren de wet van Charles, want als ze worden verwarmd, worden ze iets meer opgeblazen, terwijl ze, als ze worden ondergedompeld in vloeibare stikstof, leeglopen omdat het volume van het gas erin samentrekt..
Wet op Gay-Lussac
De wet van Gay-Lussac stelt dat bij constant volume de druk van een ideaal gas recht evenredig is met de temperatuur. In een goed gesloten ketel, als een gas progressief wordt verwarmd, zal de druk erin elke keer groter zijn, omdat de wanden van de ketel niet vervormen of uitzetten; dat wil zeggen, het volume verandert niet, het is constant.
De wet van Avogadro
Ten slotte stelt de wet van Avogadro dat het volume dat wordt ingenomen door een ideaal gas recht evenredig is met het aantal deeltjes. Dus als we één mol deeltjes hebben (6.02 · 102. 3), dan hebben we het molaire volume van het gas.
Soorten gassen
Brandbare gassen
Het zijn die gassen waarvan de componenten als brandstof fungeren, omdat ze worden gebruikt voor de productie van thermische energie. Sommigen van hen zijn aardgas, vloeibaar petroleumgas en waterstof.
Industriële gassen
Het zijn die geproduceerde gassen die aan het publiek worden verkocht voor verschillende toepassingen en toepassingen, zoals voor onder meer de gezondheid, de voeding, de milieubescherming, de metallurgie, de chemische industrie en de veiligheidssector. Enkele van deze gassen zijn onder andere zuurstof, stikstof, helium, chloor, waterstof, koolmonoxide, propaan, methaan, lachgas..
Inerte gassen
Het zijn die gassen die onder specifieke temperatuur- en drukomstandigheden geen enkele chemische reactie of een zeer lage reactie opwekken. Ze zijn neon, argon, helium, krypton en xenon. Ze worden gebruikt in chemische processen waarbij niet-reactieve elementen nodig zijn.
Voorbeelden van gasvormige elementen en verbindingen
Wat zijn de gasvormige elementen van het periodiek systeem onder aardse omstandigheden?
We hebben eerst waterstof (H), dat H-moleculen vormttwee. Helium (He), het lichtste edelgas, volgt; en vervolgens stikstof (N), zuurstof (O) en fluor (F). Deze laatste drie vormen ook twee atomen moleculen: Ntwee, OFtwee en Ftwee.
Na fluor komt neon (Ne), het edelgas dat helium volgt. Onder fluor hebben we chloor (Cl), in de vorm van Cl-moleculentwee.
Vervolgens hebben we de rest van de edelgassen: argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) en oganeson (Og).
Daarom zijn het in totaal twaalf gasvormige elementen; elf als we de zeer radioactieve en onstabiele oganeson uitsluiten.
Gasvormige verbindingen
Naast gasvormige elementen zullen enkele veel voorkomende gasvormige verbindingen worden vermeld:
-H.tweeJa, waterstofsulfide, verantwoordelijk voor de geur van rotte eieren
-NH3, ammoniak, dat scherpe aroma dat wordt aangetroffen in gebruikte zeep
-COtwee, kooldioxide, een broeikasgas
-NIETtwee, stikstofdioxide
-NO, stikstofmonoxide, een gas waarvan werd aangenomen dat het zeer giftig is, maar een belangrijke rol speelt in de bloedsomloop
-SW3, zwaveltrioxide
-C4H.10, butaan
-HCl, waterstofchloride
-OF3, ozon
-SF6, zwavelhexafluoride
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- De eigenschappen van gassen. Hersteld van: chemed.chem.purdue.edu
- Wikipedia. (2019). Gas. Hersteld van: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (5 december 2018). Gassen - Algemene eigenschappen van gassen. Hersteld van: thoughtco.com
- Harvard Men's Health Watch. (2019). De staat van gas. Hersteld van: health.harvard.edu
- Editors voor elektronicakoeling. (1 september 1998). De thermische geleidbaarheid van gassen. Hersteld van: electronics-cooling.com



Niemand heeft nog op dit artikel gereageerd.