
Eiwitglycosyleringstypen, processen en functies

De eiwitglycosylering Het is een posttranslationele modificatie die bestaat uit de toevoeging van lineaire of vertakte oligosaccharideketens aan een eiwit. De resulterende glycoproteïnen zijn in het algemeen oppervlakte-eiwitten en eiwitten uit de secretieroute..
Glycosylering is een van de meest voorkomende peptidemodificaties bij eukaryote organismen, maar er is aangetoond dat het ook voorkomt bij sommige soorten archaea en bacteriën..
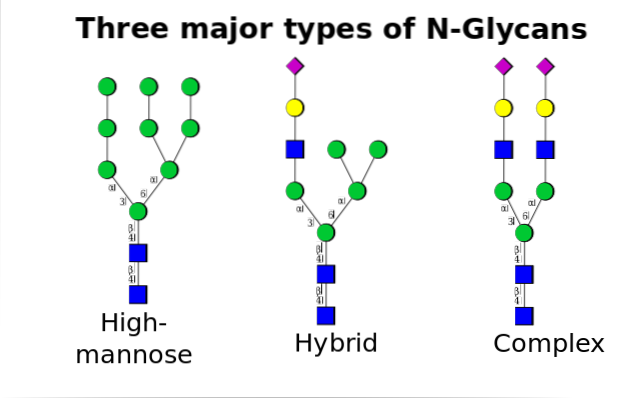
Bij eukaryoten vindt dit mechanisme plaats tussen het endoplasmatisch reticulum (ER) en het Golgi-complex, met de tussenkomst van verschillende enzymen die betrokken zijn bij zowel regulerende processen als bij de vorming van covalente bindingen van proteïne + oligosaccharide..
Artikel index
- 1 Soorten glycolyse
- 1.1 N-glycosylering
- 1.2 O-glycosylering
- 1.3 C-mannosylering
- 1.4 Glypiation (uit het Engels "Glypiation")
- 2 Proces
- 2.1 In eukaryoten
- 2.2 In prokaryoten
- 3 functies
- 3.1 Belang
- 4 referenties
Soorten glycolyse
Afhankelijk van de bindingsplaats van het oligosaccharide aan het eiwit, kan glycosylering worden ingedeeld in 4 typen:
N-glycosylering
Het komt het meest voor en treedt op wanneer oligosacchariden zich binden aan de stikstof van de amidegroep van asparagineresiduen in het Asn-X-Ser / Thr-motief, waarbij X elk aminozuur kan zijn behalve proline.
OF-glycosylering
Wanneer koolhydraten zijn gehecht aan de hydroxylgroep van serine, threonine, hydroxylysine of tyrosine. Het is een minder vaak voorkomende modificatie en zijn voorbeelden van eiwitten zoals collageen, glycoforine en mucines..
C-mannosilatatie
Het bestaat uit de toevoeging van een mannoseresidu dat zich aan het eiwit bindt door een C-C-binding met de C2 van de indoolgroep in tryptofaanresten.
Glipiation (uit het Engels "Glypiation "
Een polysaccharide fungeert als een brug om een eiwit te hechten aan een glycosylfosfatidylinositol (GPI) -anker op het membraan.
Werkwijze
In eukaryoten
De N-glycosylering is degene die in meer detail is bestudeerd. In zoogdiercellen begint het proces in het ruwe ER, waar een voorgevormd polysaccharide zich bindt aan eiwitten wanneer ze uit ribosomen komen..
Genoemde precursor polysaccharide is samengesteld uit 14 suikerresiduen, namelijk: 3 glucose (Glc), 9 mannose (Man) en 2 N-acetyl glucosamine (GlcNAc) residuen.
Deze voorloper komt veel voor in planten, dieren en eencellige eukaryote organismen. Het is aan het membraan gebonden dankzij een binding met een dolicholmolecuul, een isoprenoïde lipide ingebed in het ER-membraan..
Na zijn synthese wordt het oligosaccharide door het oligosacryltransferase-enzymcomplex overgebracht naar een asparagineresidu dat is opgenomen in de tri-peptidesequentie Asn-X-Ser / Thr van een eiwit terwijl het wordt getranslateerd..
De drie Glc-residuen aan het einde van het oligosaccharide dienen als een signaal voor een correcte oligosaccharidesynthese en worden samen met een van de Man-residuen gekliefd voordat het eiwit naar het Golgi-apparaat wordt gedragen voor verdere verwerking..
Eenmaal in het Golgi-apparaat kunnen de oligosaccharidegedeelten die aan de glycoproteïnen zijn gehecht, worden gemodificeerd door de toevoeging van galactose, siaalzuur, fucose en vele andere residuen, waardoor ketens met een veel grotere verscheidenheid en complexiteit worden verkregen..
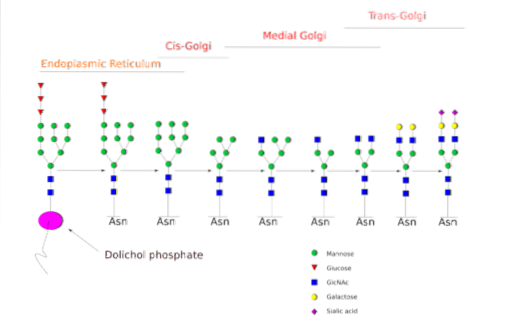
De enzymatische machinerie die nodig is om de glycosyleringsprocessen uit te voeren, omvat talrijke glycosyltransferasen voor de toevoeging van suikers, glycosidasen voor de verwijdering ervan, en verschillende nucleotidesuikertransporteurs voor de bijdrage van de residuen die als substraten worden gebruikt..
In prokaryoten
Bacteriën hebben geen intracellulaire membraansystemen, dus de vorming van het initiële oligosaccharide (van slechts 7 residuen) vindt plaats aan de cytosolische kant van het plasmamembraan..
Genoemde precursor wordt gesynthetiseerd op een lipide dat vervolgens wordt getransloceerd door een ATP-afhankelijke flipase naar de periplasmatische ruimte, waar glycosylering plaatsvindt..
Een ander belangrijk verschil tussen eukaryote en prokaryote glycosylering is dat het enzym oligosaccharidetransferase (oligosacaryltransferase) van bacteriën suikerresten kan overbrengen naar vrije delen van reeds gevouwen eiwitten, niet omdat ze worden vertaald door ribosomen..
Bovendien is het peptidemotief dat door dit enzym wordt herkend, niet dezelfde eukaryote tri-peptidesequentie..
Kenmerken
De N-oligosacchariden die aan glycoproteïnen zijn gehecht, dienen verschillende doeleinden. Sommige eiwitten hebben bijvoorbeeld deze posttranslationele modificatie nodig om de juiste vouwing van hun structuur te bereiken..
Voor anderen zorgt het voor stabiliteit, hetzij door proteolytische afbraak te vermijden, hetzij omdat dit deel nodig is om hun biologische functie te vervullen..
Aangezien oligosacchariden een sterk hydrofiel karakter hebben, wijzigt hun covalente toevoeging aan een eiwit noodzakelijkerwijs de polariteit en oplosbaarheid ervan, wat relevant kan zijn vanuit een functioneel oogpunt..
Eenmaal gehecht aan membraaneiwitten zijn oligosacchariden waardevolle informatiedragers. Ze nemen deel aan de processen van signalering, communicatie, herkenning, migratie en celadhesie.
Ze spelen een belangrijke rol bij de bloedstolling, genezing en immuunrespons, evenals bij de verwerking van eiwitkwaliteitscontrole, die glycaanafhankelijk en onmisbaar is voor de cel..
Belang
Ten minste 18 genetische ziekten zijn in verband gebracht met eiwitglycosylering bij mensen, waarvan sommige gepaard gaan met een slechte lichamelijke en geestelijke ontwikkeling, terwijl andere fataal kunnen zijn.
Er is een groeiend aantal ontdekkingen met betrekking tot glycosyleringsziekten, vooral bij pediatrische patiënten. Veel van deze aandoeningen zijn aangeboren en hebben te maken met defecten die verband houden met de eerste stadia van oligosaccharidevorming of met de regulering van de enzymen die aan deze processen deelnemen..
Aangezien een groot deel van de geglycosyleerde eiwitten de glycocalyx vormen, is er een groeiende interesse om te verifiëren dat mutaties of veranderingen in de glycosyleringsprocessen verband kunnen houden met de verandering in de micro-omgeving van tumorcellen en zo de progressie van tumoren en de ontwikkeling van tumorcellen kunnen bevorderen. metastasen bij kankerpatiënten.
Referenties
- Aebi, M. (2013). N-gebonden eiwitglycosylering in het ER. Biochimica et Biophysica Acta, 1833(11), 2430-2437.
- Dennis, J. W., Granovsky, M., & Warren, C. E. (1999). Eiwitglycosylering bij ontwikkeling en ziekte. BioEssays, eenentwintig(5), 412-421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H.,… Martin, K. (2003). Moleculaire celbiologie (5e ed.). Freeman, W. H. & Company.
- Luckey, M. (2008). Membraan structurele biologie: met biochemische en biofysische grondslagen. Cambridge University Press. Opgehaald van www.cambrudge.org/9780521856553
- Nelson, D. L., en Cox, M. M. (2009). Lehninger-principes van biochemie. Omega-edities (5e ed.).
- Nothaft, H., & Szymanski, C. M. (2010). Eiwitglycosylering in bacteriën: zoeter dan ooit. Nature beoordelingen Microbiologie, 8(11), 765-778.
- Ohtsubo, K., & Marth, J. D. (2006). Glycosylatie in cellulaire mechanismen van gezondheid en ziekte. Cel, 126(5), 855-867.
- Spiro, R. G. (2002). Eiwitglycosylering: aard, distributie, enzymatische vorming en ziekte-implicaties van glycopeptidebindingen. Glycobiologie, 12(4), 43R-53R.
- Stowell, S. R., Ju, T., & Cummings, R. D. (2015). Eiwitglycosylering bij kanker. Jaaroverzicht van pathologie: mechanismen van ziekte, 10(1), 473-510.
- Strasser, R. (2016). Glycosylering van plantaardige eiwitten. Glycobiologie, 26(9), 926-939.
- Xu, C., & Ng, D. T. W. (2015). Glycosylatiegerichte kwaliteitscontrole van eiwitvouwing. Nature beoordelingen Moleculaire celbiologie, 16(12), 742-752.
- Zhang, X., & Wang, Y. (2016). Kwaliteitscontrole van glycosylering door de Golgi-structuur. Journal of Molecular Biology, 428(16), 3183-3193.



Niemand heeft nog op dit artikel gereageerd.