
Hemostase hemostatisch proces, primair en secundair
De hemostase Het is een reeks fysiologische processen die tot doel hebben het bloeden te stoppen wanneer een bloedvatletsel optreedt. Dit mechanisme omvat de vorming van een prop of stolsel die het bloeden stopt en vervolgens alle mechanismen voor het herstellen van de schade..
Het doel van hemostase is om het cardiovasculaire systeem, dat een gesloten circulatiesysteem is, intact te houden. Het hemostatische systeem werkt daarom als een loodgieter in een waterleidingsysteem, dicht lekken of lekken af en repareert ze vervolgens om de beschadigde structuur te herstellen..
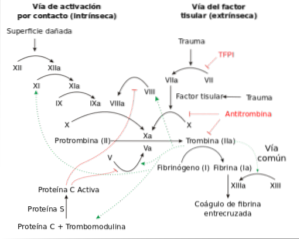
Omdat het hemostatische proces vrij complex is en de deelname van veel verschillende fysiologische mechanismen met zich meebrengt, is het opgedeeld in twee processen om de studie ervan te vergemakkelijken. We spreken dus van primaire hemostase en secundaire hemostase..
Primaire hemostase houdt zich bezig met de eerste studie van het hemostatische proces, dat wil zeggen de vorming van de bloedplaatjesplug. Secundaire hemostase zorgt zelf voor het stollingsproces.
Tweeduizend jaar geleden beschreef de Griekse filosoof Plato dat 'het bloed vezels vormde toen het het lichaam verliet'. Plato was de eerste die de term 'Fibrin”Verwijzend naar bloed.
Deze beschrijving werd later door veel andere filosofen aanvaard, maar pas eind 1800 en begin 1900 werden bloedplaatjes ontdekt en werd het eerste model van het stollingsmechanisme gemaakt..
Artikel index
- 1 Hemostatisch proces
- 2 Primaire hemostase
- 2.1 Vasoconstrictie
- 2.2 Vorming van de bloedplaatjesplug
- 3 Secundaire hemostase
- 3.1 Stolselvorming
- 3.2 Terugtrekken van het stolsel
- 3.3 Stolsellysis
- 4 referenties
Hemostatisch proces
Wanneer er schade aan een bloedvat optreedt, worden drie processen achtereenvolgens geactiveerd. Ten eerste treedt lokale vasoconstrictie op, dat wil zeggen dat de gladde spier van de vaatwand samentrekt, waardoor de diameter van het vat wordt verkleind om bloedverlies te verminderen.
Soms, wanneer de bloedvaten erg klein zijn, is de vernauwing zo effectief dat het het lumen van de buis afsluit en op zichzelf het bloeden stopt..
Schade aan het vasculaire endotheel bevordert de adhesie van bloedplaatjes aan de plaats van de verwonding en deze hechting van bloedplaatjes bevordert de aggregatie van meer bloedplaatjes die ofwel eindigen op de plaats van de verwonding of, in kleine bloedvaten, het vat kunnen blokkeren en de bloedstroom in het vat kunnen stoppen. aangetast vat.
Dit proces is zelfbeperkend, zodat de bloedplaatjesprop zich niet door het vat verspreidt, en vormt het tweede proces.
Het bloedstolsel wordt dan gevormd door de opeenvolgende activering van een reeks enzymen van het stollingssysteem die in hun inactieve vorm in het bloed circuleren. Deze processen stoppen met bloeden, maar de bloedsomloop moet worden hersteld (derde proces).
Zodra het oorspronkelijke doel is bereikt, namelijk het voorkomen van lekkage, worden de vaatwanden hersteld en wordt nu het gevormde stolsel gladgestreken of vernietigd (fibrinolyse) en stroomt het bloed weer normaal door het gehele en perfect gereconstitueerde vat..
Dit hele complexe hemostatische proces wordt streng gereguleerd, zodat de effecten ervan beperkt blijven tot het gewonde gebied en de schade snel onder controle wordt gehouden. Veranderingen in het fysiologische evenwicht of de regulatie van hemostase leiden tot pathologische toestanden die zich voordoen met trombose of bloeding.
Primaire hemostase
Primaire hemostase verwijst naar alle processen waardoor de bloedplaatjesplug zich kan vormen. Dit omvat de adhesie, activering, secretie en aggregatie van bloedplaatjes..
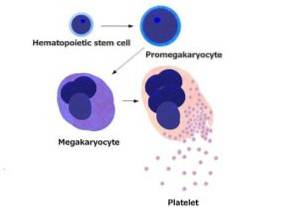
Bloedplaatjes zijn kleine celfragmenten zonder kern met een diameter van 1 tot 4 micron. Deze worden gevormd door de fractionering van cellen geproduceerd door het beenmerg die megakaryocyten worden genoemd. Bloedplaatjes hebben een halfwaardetijd van 8 tot 12 dagen en zijn zeer actieve structuren.
Vasoconstrictie
In het hemostaseproces is het eerste dat optreedt een vasoconstrictie als gevolg van samentrekking van de gladde spier van de vaatwand in het gebied van letsel. Deze contractie wordt veroorzaakt door een direct mechanisch effect van het element dat het vat verwondde en / of door activering van de perivasculaire zenuwvezels.
Vorming van bloedplaatjespluggen
Wanneer een bloedvat gewond raakt, wordt het collageen dat zich net onder het endotheel bevindt blootgesteld en bloedplaatjes hechten eraan en worden geactiveerd. Wanneer geactiveerd, worden bijgevoegde bloedplaatjes vrijgegeven adenosinedifosfaat (ADP) en thromboxane Atwee. Deze stoffen zorgen op hun beurt voor de adhesie en activering van meer bloedplaatjes.
Hechting en aggregatie kunnen doorgaan totdat een van de verwonde bloedvaten van klein kaliber volledig is geblokkeerd. Aanvankelijk zit de bloedplaatjesplug los, en tijdens het volgende stollingsproces zullen de fibrinestrengen er een stijve plug van maken.
In gebieden grenzend aan de vasculaire laesie beginnen endotheelcellen uit te scheiden prostafiline, Dit is een stof met plaatjesremmende effecten, dat wil zeggen dat het voorkomt dat bloedplaatjes aanhechten.
De afscheiding van prostafiline door het vasculaire endotheel in de gezonde gebieden perifeer van de laesie, begrenst het de verlenging, langs het vat, van de bloedplaatjesplug en beperkt het deze tot het laesiegebied.
Geactiveerde bloedplaatjes scheiden ook uit serotonine, een stof die vasoconstrictie kan versterken. Bovendien scheiden ze zich af tromboplastine, wat een stof is die een deel van de coagulatiecascade activeert, zoals later zal worden beschreven.
Door Dr Graham Beards (en) [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)], via Wikimedia Commons
Andere stoffen die door bloedplaatjes worden uitgescheiden, zijn eiwitten die "fibrinestabilisatiefactor" en een "groeifactor" worden genoemd. De groeifactor induceert de groei van endotheelcellen, fibroblasten en gladde spiercellen van het beschadigde vat.
Het uiteindelijke effect van de groei van de structuren van de vaatwand, geïnduceerd door de groeifactoren die door de bloedplaatjes worden afgegeven, is het initiëren van het herstel van de vasculaire laesie..
Secundaire hemostase
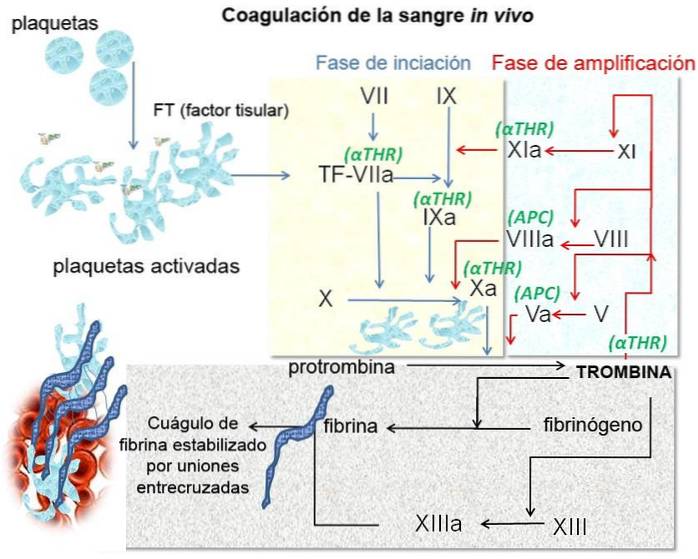
Secundaire hemostase verwijst naar het stollingsproces zelf. Het is een enzymatisch proces dat een cascade van reacties omvat waarbij oplosbaar fibrinogeen wordt omgezet in fibrine, een onoplosbare stof die polymeriseert en verknoopt om een stabiel stolsel te vormen..
Bij uitgebreide vasculaire laesies begint het stolsel ongeveer 15 tot 20 seconden na het letsel te verschijnen. Aan de andere kant blijkt dit bij lichte verwondingen 1 à 2 minuten later te zijn.
Drie soorten stoffen zijn verantwoordelijk voor het starten van deze enzymatische cascade.
1- Activerende stoffen uit de beschadigde vaatwand.
2- Stoffen geproduceerd door bloedplaatjes.
3- Bloedeiwitten die zich hechten aan de beschadigde vaatwand.
Er zijn meer dan 50 stoffen gevonden die verband houden met bloedstollingsprocessen. Deze kunnen worden ingedeeld in die welke stolling bevorderen, die procoagulantia worden genoemd, en die die stolling remmen, die anticoagulantia worden genoemd..
Het evenwicht tussen de activiteit van deze twee groepen stoffen is verantwoordelijk voor het al dan niet stollen van het bloed. Normaal gesproken overheersen anticoagulantia, met uitzondering van het gebied waar enig trauma aan een bloedvat optreedt waarin de activiteit van procoagulerende stoffen zal overheersen.
Stolselvorming
De enzymatische activeringscascade activeert uiteindelijk een groep stoffen die gezamenlijk worden genoemd protrombine-activator. Deze protrombine-activatoren katalyseren de omzetting van protrombine in trombine, en dit laatste werkt als een enzym dat fibrinogeen omzet in fibrine..
Fibrine is een vezelachtig eiwit dat polymeriseert en een netwerk vormt waarin het bloedplaatjes, bloedcellen en plasma vasthoudt. Deze fibrinevezels hechten zich bovendien aan het beschadigde oppervlak van het vat. Dit is hoe het stolsel wordt gevormd.
Stolsel intrekken
Eenmaal gevormd, begint het stolsel zich terug te trekken en knijpt al het serum dat erin zat uit. De uitgeknepen vloeistof is serum en geen plasma, aangezien deze geen stollingsfactoren of fibrinogeen bevat..
Bloedplaatjes zijn essentieel voor het optreden van stolselretractie. Deze produceren de stabiliserende factor fibrine, een procoagulerende stof. Bovendien dragen ze rechtstreeks bij aan het terugtrekkingsproces door hun eigen contractiele eiwitten (myosine) te activeren..
Stolsellysis
Een plasma-eiwit genaamd plasminogeen, ook wel profibrinolysine genoemd, zit vast in het stolsel samen met andere plasma-eiwitten. Gewonde vaatweefsels en endotheel geven een krachtige plasminogeenactivator af, genaamd tissue plasminogeenactivator (t-PA).
De afgifte van t-PA is langzaam en is binnen enkele dagen voltooid nadat het stolsel is gevormd en het bloeden is gestopt. T-PA activeert plasminogeen en zet het om in plasmine, een proteolytisch enzym dat fibrinevezels verteert en veel van de stollingsfactoren die in het stolsel opgesloten zitten.
Plasmine verwijdert dus het stolsel zodra het vat is gerepareerd. Als het stolsel zich in een klein vat bevond dat de bloedstroom blokkeerde, brengt het effect van plasmine het vat opnieuw in kanalen en wordt de doorstroming hersteld. Hiermee is het hemostatische proces beëindigd.
Referenties
- Best en Taylor's Physiological Basis of Medical Practice, 12e editie, (1998) William en Wilkins.
- Ganong, W. F., & Barrett, K. E. (2012). Ganong's review van medische fysiologie. McGraw-Hill Medical.
- Guyton AC, Hall JE: de lichaamsvloeistofcompartimenten: extracellulaire en intracellulaire vloeistoffen; Oedeem, in Textbook of Medical Physiology, 13e editie, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Smyth, S. S., McEver, R. P., Weyrich, A. S., Morrell, C. N., Hoffman, M. R., Arepally, G. M.,… & 2009 Deelnemers aan bloedplaatjescolloquium. (2009). Bloedplaatjesfuncties buiten hemostase. Journal of Thrombosis and Haemostasis, 7(11), 1759-1766.
- Versteeg, H. H., Heemskerk, J. W., Levi, M., & Reitsma, P. H. (2013). Nieuwe fundamenten in hemostase. Fysiologische beoordelingen, 93(1), 327-358.



Niemand heeft nog op dit artikel gereageerd.