
Eigenschappen van alifatische koolwaterstoffen, nomenclatuur, reacties, typen
De Alifatische koolwaterstoffen zijn allemaal die aromaticiteit missen, niet in reukzin, maar met betrekking tot chemische stabiliteit. Het op deze manier classificeren van koolwaterstoffen is tegenwoordig te dubbelzinnig en onnauwkeurig, aangezien het geen onderscheid maakt tussen verschillende soorten koolwaterstoffen die niet aromatisch zijn..
We hebben dus alifatische koolwaterstoffen en aromatische koolwaterstoffen. Deze laatste zijn te herkennen aan hun basiseenheid: de benzeenring. De andere kunnen daarentegen elke moleculaire structuur aannemen: lineair, vertakt, cyclisch, onverzadigd, polycyclisch; zolang ze geen geconjugeerde systemen hebben zoals benzeen.

De term 'alifatisch' is ontstaan uit het Griekse woord 'aleiphar', wat vet betekent, ook gebruikt om naar oliën te verwijzen. Daarom werd deze classificatie in de 19e eeuw toegekend aan koolwaterstoffen die werden verkregen uit olieachtige extracten; terwijl aromatische koolwaterstoffen werden gewonnen uit boomharsen en geurig.
Toen de fundamenten van de organische chemie echter werden geconsolideerd, werd ontdekt dat er een chemische eigenschap was die koolwaterstoffen onderscheidde, nog belangrijker dan hun natuurlijke bronnen: aromaticiteit (en niet geur).
Op deze manier zijn alifatische koolwaterstoffen niet langer alleen die welke zijn verkregen uit vetten, maar alle koolwaterstoffen die aromatisch zijn. Binnen deze familie hebben we alkanen, alkenen en alkynen, ongeacht of ze lineair of cyclisch zijn. Daarom wordt 'alifatisch' als onnauwkeurig beschouwd; hoewel het nuttig is om enkele algemene aspecten aan te pakken.
Als u bijvoorbeeld alifatische 'uiteinden' of 'ketens' zegt, verwijst u naar moleculaire gebieden waar aromatische ringen ontbreken. Van alle alifatische koolwaterstoffen is de eenvoudigste per definitie methaan, CH4terwijl benzeen de eenvoudigste van de aromatische koolwaterstoffen is.
Artikel index
- 1 Eigenschappen van alifatische koolwaterstoffen
- 2 Nomenclatuur
- 3 reacties
- 3.1 Verbranding
- 3.2 Toevoeging
- 3.3 Halogenering
- 3.4 Kraken
- 4 soorten
- 5 toepassingen
- 6 voorbeelden
- 7 referenties
Eigenschappen van alifatische koolwaterstoffen
De eigenschappen van alifatische koolwaterstoffen variëren in verschillende mate, afhankelijk van welke worden overwogen. Er zijn er met een laag en een hoog molecuulgewicht, evenals lineaire, vertakte, cyclische of polycyclische, zelfs die met verbazingwekkende driedimensionale structuren; zoals bij de Cubaan, kubusvormig.
Er zijn echter enkele algemeenheden die kunnen worden genoemd. De meeste alifatische koolwaterstoffen zijn hydrofobe en apolaire gassen of vloeistoffen, met sommige meer apolair dan andere, aangezien zelfs die koolwaterstoffen waarvan de koolstofketens halogeen-, zuurstof-, stikstof- of zwavelatomen bevatten, zijn opgenomen..
Evenzo zijn het ontvlambare verbindingen, omdat ze gevoelig zijn voor oxidatie in de lucht met een minimale warmtebron. Deze eigenschap wordt gevaarlijker als we de hoge vluchtigheid ervan toevoegen, vanwege de zwakke dispersieve interacties die alifatische moleculen bij elkaar houden..
Dit zien we bijvoorbeeld terug in butaan, een gas dat net als propaan relatief gemakkelijk vloeibaar kan worden. Beide zijn zeer vluchtig en ontvlambaar, waardoor ze actieve componenten zijn in kookgas- of zakaanstekers..
Natuurlijk neigt deze vluchtigheid af te nemen naarmate de molecuulmassa toeneemt en de koolwaterstof in toenemende mate viskeuze en olieachtige vloeistoffen produceert..
Nomenclatuur
De nomenclatuur van koolwaterstoffen verschilt zelfs meer dan hun eigenschappen. Als het alkanen, alkenen of alkynen zijn, worden dezelfde regels gevolgd als bepaald door de IUPAC: selecteer de langste keten, wijs de laagste indicatornummers toe aan het meest gesubstitueerde uiteinde of aan de meest reactieve heteroatomen of groepen.
Op deze manier is bekend op welke koolstof elke substituent zich bevindt, of zelfs de onverzadigingen (dubbele of drievoudige bindingen). In het geval van cyclische koolwaterstoffen wordt de naam voorafgegaan door de substituenten in alfabetische volgorde, gevolgd door het woord 'cyclus', waarbij de koolstofgetallen worden geteld waaruit het bestaat..
Beschouw bijvoorbeeld de volgende twee cyclohexanen:
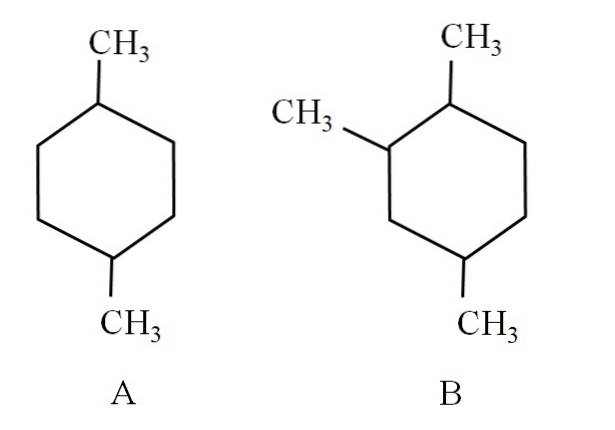
Cyclohexaan A wordt 1,4-dimethylcyclohexaan genoemd. Als de ring vijf koolstofatomen had, zou het 1,4-dimethylcyclopentaan zijn. Ondertussen wordt cyclohexaan B 1,2,4-trimethylcyclohexaan genoemd en niet 1,4,6-cyclohexaan, omdat het de laagste indicatoren probeert te gebruiken.
Nu kan de nomenclatuur erg ingewikkeld worden voor koolwaterstoffen met bizarre structuren. Voor hen zijn er meer specifieke regels, die apart en zorgvuldig moeten worden uitgelegd; zoals bij dienen, terpenen, polyenen en polycyclische verbindingen.
Reacties
Verbranding
Gelukkig zijn de reacties voor deze koolwaterstoffen minder gevarieerd. Een daarvan is al genoemd: ze verbranden gemakkelijk en produceren kooldioxide en water, evenals andere oxiden of gassen, afhankelijk van de aanwezigheid van heteroatomen (Cl, N, P, O, enz.). De COtwee en HtweeOf zijn het de belangrijkste verbrandingsproducten.
Toevoeging
Als ze onverzadigingen vertonen, kunnen ze additiereacties ondergaan; dat wil zeggen, ze nemen kleine moleculen op in hun ruggengraten als substituenten volgens een specifiek mechanisme. Onder deze moleculen bevinden zich water, waterstof en halogenen (F.twee, Cltwee, Brtwee en iktwee.
Halogenering
Aan de andere kant, alifatische koolwaterstoffen onder invloed van ultraviolette straling (hv) en warmte kan C-H-bindingen verbreken om ze in te ruilen voor C-X-bindingen (C-F, C-Cl, enz.). Dit is de halogeneringsreactie die wordt waargenomen in alkanen met een zeer korte keten, zoals methaan of pentaan..
Kraken
Een andere reactie die alifatische koolwaterstoffen, vooral alkanen met een lange keten, kunnen ondergaan, is thermisch kraken. Het bestaat uit de toevoer van intense warmte zodat de thermische energie de CC-bindingen verbreekt, en zo worden kleine moleculen gevormd, meer gewaardeerd in de brandstofmarkt, uit grote moleculen.
De vier bovenstaande reacties zijn de belangrijkste die een alifatische koolwaterstof kan ondergaan, waarbij verbranding de belangrijkste is, aangezien deze geen enkele verbinding discrimineert; ze zullen allemaal branden in de aanwezigheid van zuurstof, maar niet ze zullen allemaal moleculen toevoegen of in kleine moleculen uiteenvallen.
Types
Alifatische koolwaterstoffen groeperen een eindeloos aantal verbindingen, die op hun beurt op een meer specifieke manier worden geclassificeerd, wat de mate van hun onverzadiging aangeeft, evenals het type structuur dat ze hebben..
Afhankelijk van hoe onverzadigd ze zijn, hebben we alkanen (verzadigd), alkenen en alkynen (onverzadigd).
Alkanen worden gekenmerkt door enkele C-C-bindingen, terwijl we in alkenen en alkynen respectievelijk C = C- en C≡C-bindingen zien. Een zeer algemene manier om ze te visualiseren, is door de koolstofskeletten van alkanen te zien als zigzaggende en gebogen ketens, als "vierkanten" voor alkenen en "rechte lijnen" voor alkynen..
Dit komt door het feit dat de dubbele en drievoudige bindingen energie en sterische beperkingen in hun rotaties vertonen, waardoor hun structuren "verharden"..
Alkanen, alkenen en alkynen kunnen vertakt, cyclisch of polycyclisch zijn. Dat is de reden waarom cycloalkanen, cycloalkenen, cycloalkinen en verbindingen zoals decaline (bicyclo-structuur), adamantaan (vergelijkbaar met een baseballpet), heptaleen, gonaan, onder andere ook worden beschouwd als alifatische koolwaterstoffen..
Andere soorten koolwaterstoffen ontstaan uit alkenen, zoals dienen (met twee dubbele bindingen), polyenen (met veel afwisselende dubbele bindingen) en terpenen (verbindingen afgeleid van isopreen, een dieen).
Toepassingen
Nogmaals, het gebruik van deze koolwaterstoffen kan variëren, afhankelijk van welke wordt overwogen. In de secties over eigenschappen en reacties werd echter duidelijk gemaakt dat ze allemaal branden, niet alleen om gasvormige moleculen vrij te maken, maar ook licht en warmte. Het zijn dus energiereservoirs die kunnen dienen als brandstof of warmtebronnen..
Daarom worden ze gebruikt als onderdeel van de samenstelling van benzine, voor aardgas, in bunsenbranders en in het algemeen om vuur te kunnen maken..
Een van de meest opmerkelijke voorbeelden is dat van acetyleen, HC≡CH, waarvan de verbranding het mogelijk maakt de metaalionen van een monster te exciteren in atoomabsorptiespectrometrie die wordt uitgevoerd in analytische tests. Ook kan het resulterende vuur worden gebruikt om te lassen.
Vloeibare alifatische koolwaterstoffen, zoals paraffinics, worden vaak gebruikt als extractiemiddel voor vetten. Bovendien kan de oplossende werking worden gebruikt om vlekken, email, verf te verwijderen of gewoon om oplossingen van een bepaalde organische verbinding te bereiden.
Degenen met de hoogste molecuulmassa, viskeus of vast, worden gebruikt voor de productie van harsen, polymeren of medicijnen.
De term 'alifatisch' wordt vaak gebruikt om te verwijzen naar die regio's, in een macromolecuul, die aromaticiteit missen. Asfaltenen worden bijvoorbeeld oppervlakkig beschreven als een aromatische kern met alifatische ketens.
Voorbeelden
In eerste instantie werd gezegd dat methaan de eenvoudigste van de alifatische koolwaterstoffen is. Het wordt gevolgd door propaan, CH3CHtweeCH3, butaan, CH3CHtweeCHtweeCH3, pentaan, CH3CHtweeCHtweeCHtweeCH3, octaan, nonaan, decaan, enzovoort, met steeds langere alkanen.
Hetzelfde geldt voor ethyleen, CHtwee= CHtwee, propeen, CH3CH = CHtwee, buteen, CH3CHtweeCH = CH3, en voor de rest van de alkynen. Als er twee dubbele bindingen zijn, zijn het dienen, en als er meer dan twee zijn, polyenen. Evenzo kunnen er dubbele en drievoudige bindingen in hetzelfde skelet zijn, waardoor de structurele complexiteit toeneemt..
Onder de cycloalkanen kunnen we cyclopropaan, cyclobutaan, cyclopentaan, cyclohexaan, cycloheptaan, cyclooctaan noemen, evenals cyclohexeen en cyclohexine. Vertakte derivaten worden op hun beurt verkregen uit al deze koolwaterstoffen, de beschikbare voorbeelden vermenigvuldigen zich nog meer (zoals 1,4-dimethylcyclohexaan).
Van de meest representatieve terpenen hebben we limoneen, menthol, pineen, vitamine A, squaleen, enz. Polyethyleen is een polymeer verzadigd met -CH-eenhedentwee-CHtwee-, het is dus ook een voorbeeld van deze koolwaterstoffen. Andere voorbeelden zijn al genoemd in de vorige paragrafen.
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Helmenstine, Anne Marie, Ph.D. (22 augustus 2019). Definitie van alifatische koolwaterstoffen. Hersteld van: thoughtco.com
- Wikipedia. (2019). Alifatische verbinding. Hersteld van: en.wikipedia.org
- Chemie LibreTexts. (20 augustus 2019). Alifatische koolwaterstoffen. Hersteld van: chem.libretexts.org
- Elizabeth Wyman. (2019). Alifatische koolwaterstoffen: definitie en eigenschappen. Studie. Hersteld van: study.com


Niemand heeft nog op dit artikel gereageerd.