
Eigenschappen en voorbeelden van onverzadigde koolwaterstoffen

De onverzadigde koolwaterstoffen zijn degenen die ten minste één dubbele koolstofbinding in hun structuur bevatten, omdat ze een drievoudige binding kunnen bevatten, aangezien de verzadiging van een ketting betekent dat deze alle mogelijke waterstofatomen in elk koolstofatoom heeft ontvangen, en er zijn geen paren vrije elektronen waar er kunnen meer waterstofatomen binnendringen.
Onverzadigde koolwaterstoffen zijn onderverdeeld in twee soorten: alkenen en alkynen. Alkenen zijn koolwaterstofverbindingen die een of meer dubbele bindingen in hun molecuul hebben. Ondertussen zijn alkynen koolwaterstofverbindingen die een of meer drievoudige bindingen in hun formule hebben..
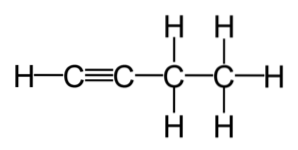
Alkenen en alkynen worden vaak commercieel gebruikt. Dit zijn verbindingen met een hogere reactiviteit dan die van verzadigde koolwaterstoffen, waardoor ze het startpunt zijn van vele reacties, gegenereerd uit de meest voorkomende alkenen en alkynen..
Artikel index
- 1 Nomenclatuur
- 1.1 Nomenclatuur van alkenen
- 1.2 Nomenclatuur van alkynen
- 2 Eigenschappen
- 2.1 Dubbele en drievoudige bindingen
- 2.2 cis-trans-isomerisatie
- 2.3 Zuurheid
- 2.4 Polariteit
- 2.5 Kook- en smeltpunten
- 3 voorbeelden
- 3.1 Ethyleen (C2H4)
- 3.2 Ethine (C2H2)
- 3.3 Propyleen (C3H6)
- 3.4 Cyclopenteen (C5H8)
- 4 artikelen van belang
- 5 referenties
Nomenclatuur
Onverzadigde koolwaterstoffen krijgen een andere naam, afhankelijk van of ze alkenen of alkynen zijn, met de achtervoegsels '-eno' en '-ino'.
Alkenen hebben ten minste één dubbele koolstof-koolstofbinding in hun structuur en hebben de algemene formule C.nH.2n, terwijl alkynen ten minste één drievoudige binding bevatten en worden behandeld door de formule CnH.2n-2.
Nomenclatuur van alkenen
Om alkenen te noemen, moeten de posities van de dubbele koolstof-koolstofbindingen worden aangegeven. De namen van chemische verbindingen die C = C-bindingen bevatten, eindigen met het achtervoegsel "-eno".
Net als bij alkanen wordt de naam van de baseverbinding bepaald door het aantal koolstofatomen in de langste keten. Bijvoorbeeld het molecuul CHtwee= CH-CHtwee-CH3 heet "1-buteen", maar dat van H3C-CH = CH-CH3 zal zichzelf "2-buteen" noemen.
De getallen die in de namen van deze verbindingen worden waargenomen, geven het koolstofatoom aan met het kleinste getal in de keten waarin de C = C-binding van het alkeen zich bevindt..
Het aantal koolstofatomen in deze keten identificeert het voorvoegsel van de naam, vergelijkbaar met alkanen ("met-", "et-", "pro-", "but-", enz.), Maar altijd met het achtervoegsel "-eno ".
Het moet ook worden gespecificeerd of het molecuul cis of trans is, dit zijn soorten geometrische isomeren. Dit wordt in de naam toegevoegd, zoals 3-ethyl-cis-2-heptaan of 3-ethyl-trans-2-heptaan.
Nomenclatuur van alkynen
Om de namen te raden van chemische verbindingen die drievoudige C≡C-bindingen bevatten, wordt de naam van de verbinding bepaald door het aantal C-atomen in de langste keten.
Net als bij alkenen geven de namen van alkynen de positie aan waarin de koolstof-koolstof drievoudige binding wordt aangetroffen; bijvoorbeeld in het geval van HC = C-CHtwee-CH3, of "1-butyn", en H3C-C≡C-CH3, of "2-butyn".
Eigendommen
Onverzadigde koolwaterstoffen bestaan uit een enorm aantal verschillende moleculen, en daarom vertonen ze een reeks kenmerken die hen definiëren, die hieronder worden geïdentificeerd:
Dubbele en drievoudige bindingen
De dubbele en drievoudige bindingen van alkenen en alkynen hebben speciale kenmerken die hen onderscheiden van enkele bindingen: een enkele binding vertegenwoordigt de zwakste van de drie en wordt gevormd door een sigma-binding tussen twee moleculen.
De dubbele binding wordt gevormd door één sigma-binding en één pi, en de drievoudige binding door één sigma-binding en twee pi. Dit maakt de alkenen en alkynen sterker en vereist meer energie om af te breken als er reacties optreden..
Verder zijn de bindingshoeken die worden gevormd in een dubbele binding 120 °, terwijl die van de drievoudige binding 180 ° zijn. Dit betekent dat moleculen met drievoudige bindingen een lineaire hoek hebben tussen deze twee koolstofatomen..
Cis-trans-isomerisatie
In alkenen en andere verbindingen met dubbele bindingen treedt een geometrische isomerisatie op, die verschilt aan de kant van de bindingen waarin de functionele groepen worden aangetroffen die zijn gehecht aan de koolstofatomen die bij deze dubbele binding betrokken zijn..
Wanneer de functionele groepen van een alkeen in dezelfde richting zijn georiënteerd met betrekking tot de dubbele binding, wordt dit molecuul cis genoemd, maar wanneer de substituenten in verschillende richtingen zijn, wordt het trans genoemd..
Deze isomerisatie is niet eenvoudig een verschil in locatie; verbindingen kunnen enorm variëren alleen omdat ze cis-geometrie of trans-geometrie zijn.
Cis-verbindingen hebben meestal betrekking op dipool-dipoolkrachten (die een nettowaarde van nul hebben in transs); Bovendien hebben ze een hogere polariteit, kook- en smeltpunten en hebben ze een hogere dichtheid dan hun trans-tegenhangers. Bovendien zijn transverbindingen stabieler en geven ze minder verbrandingswarmte af..
Zuurgraad
Alkenen en alkynen hebben een hogere zuurgraad in vergelijking met alkanen, vanwege de polariteit van hun dubbele en drievoudige bindingen. Ze zijn minder zuur dan alcoholen en carbonzuren; en van de twee zijn alkynen zuurder dan alkenen.
Polariteit
De polariteit van alkenen en alkynen is laag, vooral in trans-alkeenverbindingen, waardoor deze verbindingen onoplosbaar zijn in water..
Toch lossen onverzadigde koolwaterstoffen gemakkelijk op in gewone organische oplosmiddelen zoals ethers, benzeen, tetrachloorkoolstof en andere verbindingen met een lage of geen polariteit..
Kook- en smeltpunten
Vanwege hun lage polariteit zijn de kook- en smeltpunten van onverzadigde koolwaterstoffen laag, bijna gelijk aan die van alkanen met dezelfde koolstofstructuur..
Toch hebben alkenen lagere kook- en smeltpunten dan de overeenkomstige alkanen, en kunnen ze zelfs nog meer dalen als ze cis-isomeer zijn, zoals eerder vermeld..
Daarentegen hebben alkynen hogere kook- en smeltpunten dan alkanen en de overeenkomstige alkenen, hoewel het verschil slechts enkele graden is..
Ten slotte hebben cycloalkenen ook lagere smelttemperaturen dan de overeenkomstige cycloalkanen, vanwege de stijfheid van de dubbele binding..
Voorbeelden
Ethyleen (C.tweeH.4
Een krachtige chemische verbinding vanwege onder meer zijn polymerisatie-, oxidatie- en halogeneringsvermogen.
Ethyne (C.tweeH.twee
Ook wel acetyleen genoemd, het is een brandbaar gas dat wordt gebruikt als een nuttige bron van verlichting en warmte..
Propyleen (C.3H.6
De op een na meest gebruikte verbinding in de chemische industrie ter wereld, het is een van de producten van de thermolyse van aardolie.
Cyclopenteen (C.5H.8
Een verbinding van het cycloalkeen-type. Deze stof wordt gebruikt als monomeer voor de synthese van kunststoffen.
Artikelen van belang
Verzadigde koolwaterstoffen of alkanen.
Referenties
- Chang, R. (2007). Chemistry, negende editie. Mexico: McGraw-Hill.
- Wikipedia. (s.f.). Alkenen. Opgehaald van en.wikipedia.org
- Boudreaux, K. A. (s.f.). Onverzadigde koolwaterstoffen. Opgehaald van angelo.edu
- Tuckerman, M. E. (s.f.). Alkenen en Alkynes. Opgehaald van nyu.edu
- Universiteit, L. T. (s.f.). De onverzadigde koolwaterstoffen: alkenen en alkynen. Opgehaald van chem.latech.edu


Niemand heeft nog op dit artikel gereageerd.