
Lithiumhydride structuur, eigenschappen, productie, gebruik

De lithiumhydride het is een kristallijne anorganische vaste stof waarvan de chemische formule LiH is. Het is het lichtste anorganische zout, het molecuulgewicht is slechts 8 g / mol. Het wordt gevormd door de vereniging van een lithium-ion Li+ en een hydride-ion H-. Beide zijn verbonden door een ionische binding.
LiH heeft een hoog smeltpunt. Het reageert gemakkelijk met water en daarbij wordt waterstofgas geproduceerd. Het kan worden verkregen door de reactie tussen gesmolten lithiummetaal en waterstofgas. Het wordt veel gebruikt in chemische reacties om andere hydriden te verkrijgen.
LiH is gebruikt om te beschermen tegen gevaarlijke straling zoals die in kernreactoren wordt aangetroffen, dat wil zeggen ALPHA, BETA, GAMMA-straling, protonen, röntgenstralen en neutronen..
Er is ook voorgesteld voor de bescherming van materialen in ruimteraketten die worden aangedreven door nucleaire thermische voortstuwing. Er worden zelfs studies uitgevoerd om te worden gebruikt als bescherming van de mens tegen kosmische straling tijdens toekomstige reizen naar de planeet Mars..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Zelfontbrandingstemperatuur
- 3.6 Dichtheid
- 3.7 Oplosbaarheid
- 3.8 Overige eigenschappen
- 4 Verkrijgen
- 5 Gebruik als beschermend schild tegen gevaarlijke straling
- 5.1 - In kernreactoren
- 5.2 - In ruimtesystemen met nucleaire thermische voortstuwing
- 5.3 - Ter bescherming tegen kosmische straling
- 6 Gebruik als middel voor veilige opslag en transport van waterstof
- 7 Gebruik bij chemische reacties
- 8 referenties
Structuur
Waterstof in lithiumhydride heeft een negatieve lading H.-, omdat het een elektron heeft afgetrokken van het metaal, dat de vorm heeft van een Li-ion+.
De elektronenconfiguratie van het Li-kation+ is: [Hij] 1stwee wat erg stabiel is. En de elektronische structuur van het hydride-anion H- is: 1stwee, die ook erg stabiel is.
Het kation en anion worden met elkaar verbonden door elektrostatische krachten.
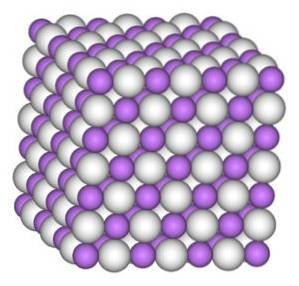
Het lithiumhydride-kristal heeft dezelfde structuur als natriumchloride-NaCl, dat wil zeggen een kubische kristalstructuur.
Nomenclatuur
- Lithiumhydride
- LiH
Eigendommen
Fysieke toestand
Witte of kleurloze kristallijne vaste stof. Commercieel LiH kan blauwgrijs zijn vanwege de aanwezigheid van kleine hoeveelheden lithiummetaal..
Molecuulgewicht
8 g / mol
Smeltpunt
688 ºC
Kookpunt
Het ontleedt bij 850 ºC.
Zelfontbranding temperatuur
200 ºC
Dichtheid
0,78 g / cm3
Oplosbaarheid
Reageert met water. Het is onoplosbaar in ethers en koolwaterstoffen.
Andere eigenschappen
Lithiumhydride is veel stabieler dan hydriden van de andere alkalimetalen en kan zonder ontleding worden gesmolten..
Het wordt niet beïnvloed door zuurstof als het wordt verwarmd tot temperaturen onder rood. Het wordt ook niet beïnvloed door chloor Cltwee en zoutzuur HCl.
Het contact van LiH met warmte en vochtigheid veroorzaakt een exotherme reactie (genereert warmte) en ontwikkeling van waterstof Htwee en lithiumhydroxide LiOH.
Het kan een fijn stof vormen dat kan ontploffen in contact met vlammen, hitte of oxiderende materialen. Het mag niet in contact komen met lachgas of vloeibare zuurstof, aangezien het kan exploderen of ontbranden.
Het wordt donkerder bij blootstelling aan licht.
Het verkrijgen van
Lithiumhydride is in het laboratorium verkregen door reactie tussen gesmolten lithiummetaal en waterstofgas bij een temperatuur van 973 K (700 ºC).
2 Li + Htwee → 2 LiH
Goede resultaten worden verkregen wanneer het blootgestelde oppervlak van het gesmolten lithium wordt vergroot en wanneer de sedimentatietijd van het LiH wordt verkort. Het is een exotherme reactie.
Gebruik als beschermend schild tegen gevaarlijke straling
LiH heeft een aantal eigenschappen die het aantrekkelijk maken om te gebruiken als bescherming voor mensen in kernreactoren en ruimtesystemen. Hier zijn enkele van deze kenmerken:
- Het heeft een hoog gehalte aan waterstof (12,68% in gewicht van H) en een hoog aantal waterstofatomen per volume-eenheid (5,85 x 1022 H atomen / cm3.
- Door het hoge smeltpunt kan het worden gebruikt in omgevingen met hoge temperaturen zonder te smelten.
- Het heeft een lage dissociatiedruk (~ 20 torr op het smeltpunt) waardoor het materiaal kan worden gesmolten en ingevroren zonder te verslechteren onder lage waterstofdruk..
- Het heeft een lage dichtheid waardoor het aantrekkelijk is voor gebruik in ruimtesystemen..
- De nadelen zijn echter het lage warmtegeleidingsvermogen en de slechte mechanische eigenschappen. Maar dit heeft de toepasbaarheid ervan niet verminderd.
- De LiH-onderdelen die als schilden dienen, worden vervaardigd door warm of koud persen en door smelten en gieten in mallen. Hoewel deze laatste vorm de voorkeur heeft.
- Bij kamertemperatuur worden de onderdelen beschermd tegen water en waterdamp en bij hoge temperaturen door een kleine overdruk waterstof in een afgesloten container.
- In kernreactoren
In kernreactoren zijn er twee soorten straling:
Direct ioniserende straling
Het zijn hoogenergetische deeltjes die elektrische lading dragen, zoals alfa- (α) en bèta (β) -deeltjes en protonen. Dit type straling heeft een zeer sterke wisselwerking met de materialen van de schilden en veroorzaakt ionisatie door interactie met de elektronen van de atomen van de materialen waardoor ze passeren..
Indirect ioniserende straling
Het zijn neutronen, gammastralen (γ) en röntgenstralen, die doordringen en enorme bescherming vereisen, aangezien ze de emissie van secundair geladen deeltjes met zich meebrengen, die ionisatie veroorzaken..

Volgens sommige bronnen is LiH effectief in het beschermen van materialen en mensen tegen dit soort straling.
- In ruimtesystemen van nucleaire thermische voortstuwing
LiH is onlangs gekozen als een potentiële moderator en als een materiaal voor het afschermen van nucleaire straling voor nucleaire thermische voortstuwingssystemen van ruimtevaartuigen met zeer lange reizen..

De lage dichtheid en het hoge waterstofgehalte maken het mogelijk om de massa en het volume van de kernreactor effectief te verminderen..
- Ter bescherming tegen kosmische straling
Blootstelling aan ruimtestraling is het belangrijkste risico voor de menselijke gezondheid bij toekomstige interplanetaire verkenningsmissies.
In de ruimte zullen astronauten worden blootgesteld aan het volledige spectrum van galactische kosmische straling (hoogenergetische ionen) en uitwerpingsgebeurtenissen van zonnedeeltjes (protonen)..
Het gevaar van blootstelling aan straling wordt nog vergroot door de lengte van de missies. Daarnaast moet ook rekening worden gehouden met de bescherming van de plaatsen die ontdekkingsreizigers zullen bewonen.

In die geest gaf een studie uit 2018 aan dat LiH van de geteste materialen de grootste reductie in straling per gram per cm geeft.twee, dus een van de beste kandidaten om te worden gebruikt bij de bescherming tegen kosmische straling. Deze onderzoeken moeten echter worden verdiept.
Gebruik als veilig opslag- en transportmedium voor waterstof
Energie halen uit Htwee Het is iets dat al enkele tientallen jaren wordt bestudeerd en al een toepassing heeft gevonden om fossiele brandstoffen in transportvoertuigen te vervangen.
De Htwee kunnen worden gebruikt in brandstofcellen en bijdragen aan de vermindering van de CO-productietwee en neeX, waardoor het broeikaseffect en de vervuiling worden vermeden. Een effectief systeem voor opslag en transport van H is echter nog niet gevondentwee veilig, lichtgewicht, compact of klein van formaat, snel op te bergen en de Htwee even snel.
Lithiumhydride LiH is een van de alkalihydriden met de hoogste opslagcapaciteit voor H.twee (12,7 gew.% H). Laat H lostwee door hydrolyse volgens de volgende reactie:
LiH + HtweeO → LiOH + Htwee
LiH levert 0,254 kg waterstof voor elke kg LiH. Bovendien heeft het een hoge opslagcapaciteit per volume-eenheid, wat betekent dat het lichtgewicht is en een compact medium is voor opslag van Htwee.

Bovendien vormt LiH gemakkelijker dan andere alkalimetaalhydriden en is het chemisch stabiel bij omgevingstemperaturen en -drukken. De LiH kan van de fabrikant of leverancier naar de gebruiker worden vervoerd. Vervolgens wordt door hydrolyse van LiH H gegenereerdtwee en dit wordt veilig gebruikt.
Het gevormde lithiumhydroxide LiOH kan worden teruggestuurd naar de leverancier die het lithium regenereert door middel van elektrolyse en vervolgens weer LiH produceert..
LiH is ook met succes bestudeerd om voor hetzelfde doel te worden gebruikt in combinatie met boraathydrazine..
Gebruik bij chemische reacties
LiH maakt de synthese van complexe hydriden mogelijk.
Het wordt bijvoorbeeld gebruikt om lithiumtriethylboorhydride te bereiden, een krachtig nucleofiel in organische halogenidevervangingsreacties..
Referenties
- Sato, Y. en Takeda, O. (2013). Opslag- en transportsysteem voor waterstof door middel van lithiumhydride met behulp van gesmolten zouttechnologie. In Molten Salts Chemistry. Hoofdstuk 22, pagina's 451-470. Opgehaald van sciencedirect.com.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Lithiumhydride. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Wang, L. et al. (2019). Onderzoek naar de impact van het thermische kernel-effect van lithiumhydride op de reactiviteit van een nucleaire voortstuwingsdeeltjesbedreactor. Annals of Nuclear Energy 128 (2019) 24-32. Opgehaald van sciencedirect.com.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Giraudo, M. et al. (2018). Accelerator-gebaseerde tests van de afschermingseffectiviteit van verschillende materialen en meerlagen met behulp van hoogenergetische lichte en zware ionen. Radiation Research 190; 526-537 (2018). Opgehaald van ncbi.nlm.nih.gov.
- Welch, F.H. (1974). Lithiumhydride: een materiaal dat de ruimte leeftijd beschermt. Nuclear Engineering and Design 26, 3, februari 1974, pagina's 444-460. Opgehaald van sciencedirect.com.
- Simnad, M.T. (2001). Kernreactoren: afschermingsmaterialen. In Encyclopedia of Materials: Science and Technology (Second Edition). Pagina's 6377-6384. Opgehaald van sciencedirect.com.
- Hügle, T. et al. (2009). Hydrazine Borane: een veelbelovend waterstofopslagmateriaal. J. Am. Chem. Soc. 2009, 131, 7444-7446. Opgehaald van pubs.acs.org.



Niemand heeft nog op dit artikel gereageerd.