
Kwikhydroxidestructuur, eigenschappen, gebruik, risico's

De kwikhydroxide Het is een anorganische verbinding waarin het metaalkwik (Hg) een oxidatiegetal heeft van 2+. De chemische formule is Hg (OH)twee. Deze soort is echter onder normale omstandigheden nog niet in vaste vorm verkregen..
Kwikhydroxide of kwikhydroxide is een kortstondig tijdelijk tussenproduct bij de vorming van kwikoxide HgO in alkalische oplossing. Uit onderzoeken die zijn uitgevoerd in oplossingen van kwikoxide HgO, is afgeleid dat Hg (OH)twee het is een zwakke basis. Andere soorten die ermee gepaard gaan, zijn HgOH+ en de Hgtwee+.

Ondanks dat het niet kan worden neergeslagen in een waterige oplossing, kan Hg (OH)twee Het is verkregen door de fotochemische reactie van kwik met waterstof en zuurstof bij zeer lage temperaturen. Het is ook verkregen in de vorm van een coprecipitaat samen met Fe (OH)3, waar de aanwezigheid van halogenide-ionen de pH beïnvloedt waarbij co-precipitatie optreedt.
Omdat het op laboratoriumniveau niet gemakkelijk zuiver te verkrijgen is, was het niet mogelijk om enig nut voor deze verbinding te vinden, noch om de risico's van het gebruik ervan te bepalen. Er kan echter worden afgeleid dat het dezelfde risico's met zich meebrengt als de andere kwikverbindingen.
Artikel index
- 1 Structuur van het molecuul
- 2 Elektronische configuratie
- 3 Nomenclatuur
- 4 Eigenschappen
- 4.1 Molecuulgewicht
- 4.2 Chemische eigenschappen
- 5 Verkrijgen
- 5.1 Zuiver kwikhydroxide
- 5.2 Co-precipitatie met ijzer (III) hydroxide
- 6 toepassingen
- 7 Recente onderzoeken
- 8 Risico's
- 9 referenties
Structuur van het molecuul
De structuur van kwik (II) hydroxide Hg (OH)twee het is gebaseerd op een lineair centraal gedeelte gevormd door het kwikatoom met de twee zuurstofatomen aan de zijkanten.
Aan deze centrale structuur zijn waterstofatomen bevestigd, elk naast elke zuurstof, die vrij rond elke zuurstof draaien. Het kan op een eenvoudige manier als volgt worden weergegeven:
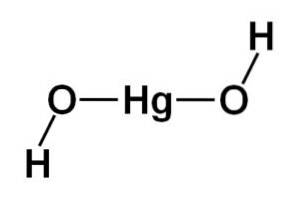
Elektronische configuratie
De elektronische structuur van metallisch kwik Hg is als volgt:
[Xe] 5d10 6stwee
waarbij [Xe] de elektronenconfiguratie is van het edelgas xenon.
Bij het observeren van deze elektronische structuur wordt afgeleid dat de meest stabiele oxidatietoestand van kwik die is waarin de 2 elektronen van laag 6 verloren gaan.s.
In kwikhydroxide Hg (OH)twee, het kwikatoom (Hg) bevindt zich in de oxidatietoestand 2+. Daarom, in de Hg (OH)twee kwik heeft de volgende elektronische configuratie:
[Xe] 5d10
Nomenclatuur
- Kwik (II) hydroxide
- Kwikhydroxide
- Kwikdihydroxide
Eigendommen
Molecuulgewicht
236,62 g / mol
Chemische eigenschappen
Volgens de geraadpleegde informatie is het mogelijk dat Hg (OH)twee een tijdelijke verbinding zijn bij de vorming van HgO in een alkalisch waterig medium.
De toevoeging van hydroxylionen (OH-) tot een waterige oplossing van kwikionen Hgtwee+ leidt tot het neerslaan van een gele vaste stof van kwik (II) oxide HgO, waarvan Hg (OH)twee is een tijdelijke of tijdelijke functionaris.

In waterige oplossing Hg (OH)twee Het is een zeer kortstondig tussenproduct, omdat het snel een watermolecuul afgeeft en vast HgO neerslaat.
Hoewel het niet mogelijk was om kwikhydroxide Hg (OH) neer te slaantwee, kwik (II) oxide HgO is enigszins oplosbaar in water en vormt een oplossing van soorten die 'hydroxiden' worden genoemd.
Deze soorten in water die ‘hydroxiden’ worden genoemd, zijn zwakke basen en hoewel ze zich soms als amfoteer gedragen, is in het algemeen Hg (OH)twee het is basischer dan zuur.
Wanneer HgO oplost in HClO4 studies wijzen op de aanwezigheid van kwikionen Hgtwee+, een monohydroxymercurisch ion HgOH+ en kwikhydroxide Hg (OH)twee.
De evenwichten die optreden in dergelijke waterige oplossingen zijn als volgt:
Hgtwee+ + H.tweeO ⇔ HgOH+ + H.+
HgOH+ + H.tweeO ⇔ Hg (OH)twee + H.+
In alkalische oplossingen van NaOH wordt de soort Hg (OH) gevormd3-.
Het verkrijgen van
Zuiver kwikhydroxide
Kwik (II) Hydroxide Hg (OH)twee Het kan niet worden verkregen in een waterige oplossing, omdat bij het toevoegen van alkali aan een oplossing van kwikionen Hgtwee+, geel kwikoxide HgO slaat neer.
Sommige onderzoekers slaagden er echter in 2005 voor het eerst in om kwikhydroxide Hg (OH) te verkrijgentwee met behulp van een kwikbooglamp, uitgaande van het element kwik Hg, waterstof Htwee en zuurstof Otwee.

De reactie is fotochemisch en werd uitgevoerd in aanwezigheid van vast neon, argon of deuterium bij zeer lage temperaturen (rond 5 K = 5 graden Kelvin). Bewijs van verbindingvorming werd verkregen door IR (infrarood) lichtabsorptiespectra.
Hg (OH)twee op deze manier voorbereid, is het zeer stabiel onder de omstandigheden van ervaring. Geschat wordt dat de fotochemische reactie verloopt via het tussenliggende O-Hg-O naar het stabiele molecuul H-O-Hg-O-H.
Coprecipitatie met ijzer (III) hydroxide
Als kwik (II) sulfaat HgSO oplost4 en ijzer (III) sulfaat Fetwee(ZW43 in zure waterige oplossing, en de pH begint te stijgen door een oplossing van natriumhydroxide NaOH toe te voegen, na een rusttijd wordt een vaste stof gevormd waarvan wordt aangenomen dat het een co-neerslag is van Hg (OH)twee en Fe (OH)3.
Het is gebleken dat de vorming van Hg (OH)twee is een cruciale stap in deze co-precipitatie met Fe (OH)3.
De vorming van Hg (OH)twee in het neerslag Fe (OH)3-Hg (OH)twee hangt sterk af van de aanwezigheid van ionen zoals fluoride, chloride of bromide, van hun specifieke concentratie en van de pH van de oplossing.
In aanwezigheid van fluoride (F.-), bij een pH hoger dan 5, de coprecipitatie van Hg (OH)twee met Fe (OH)3 het wordt niet beïnvloed. Maar bij een pH van 4 vormt de vorming van complexen tussen Hgtwee+ en de F- interfereert met de co-precipitatie van Hg (OH)twee.
In het geval van aanwezigheid van chloride (Cl-), de co-precipitatie van Hg (OH)twee treedt op bij een pH van 7 of hoger, dat wil zeggen bij voorkeur in een alkalisch milieu.
Wanneer bromide (Br-), de co-precipitatie van Hg (OH)twee komt voor bij zelfs hogere pH, dat wil zeggen pH boven 8,5, of meer alkalisch dan met chloride.
Toepassingen
Uit het overzicht van de beschikbare informatiebronnen wordt afgeleid dat kwik (II) hydroxide Hg (OH)twee, Omdat het een verbinding is die nog niet commercieel is bereid, zijn er geen toepassingen bekend.
Recent onderzoek
Met behulp van computersimulatietechnieken werden in 2013 de structurele en energetische kenmerken van de hydratatie van Hg (OH) bestudeerd.twee in gasvormige toestand.
Metaalligandcoördinatie en solvatatie-energieën werden berekend en vergeleken door de mate van hydratatie van Hg (OH) te variërentwee.
Er werd onder andere gevonden dat de theoretische oxidatietoestand blijkbaar 1+ is in plaats van de veronderstelde 2+ die gewoonlijk wordt toegekend aan Hg (OH)twee.
Risico's
Hoewel Hg (OH)twee als zodanig is het niet in voldoende hoeveelheid geïsoleerd en daarom niet commercieel gebruikt, zijn de specifieke risico's niet bepaald, maar er kan worden afgeleid dat het dezelfde risico's met zich meebrengt als de rest van kwikzouten.
Het kan giftig zijn voor het zenuwstelsel, het spijsverteringsstelsel, de huid, de ogen, de luchtwegen en de nieren..
Inademing, inslikken of contact met de huid van kwikverbindingen kan schade veroorzaken, variërend van oog- en huidirritatie, slapeloosheid, hoofdpijn, tremoren, schade aan het darmkanaal, geheugenverlies tot nierfalen, naast andere symptomen.
Kwik wordt internationaal erkend als een vervuilende stof. De meeste kwikverbindingen die in contact komen met het milieu worden gemethyleerd door bacteriën die aanwezig zijn in bodems en sedimenten, waarbij methylkwik wordt gevormd.
Deze verbinding bioaccumuleert in levende organismen en gaat van de bodem naar planten en van daaruit naar dieren. In het aquatisch milieu gaat de overdracht zelfs nog sneller, gaande van zeer kleine naar grote soorten in korte tijd.
Methylkwik heeft een toxische werking voor levende wezens en in het bijzonder voor mensen, die het via de voedselketen binnenkrijgen.
Wanneer het met voedsel wordt ingenomen, is het vooral schadelijk voor jonge kinderen en foetussen bij zwangere vrouwen, omdat het een neurotoxine is en schade kan toebrengen aan de hersenen en het zenuwstelsel bij de vorming en groei..
Referenties
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Wang, Xuefeng en Andrews, Lester (2005). Infrarood spectrum van Hg (OH)twee in Solid Neon en Argon. Anorganic Chemistry, 2005, 44, 108-113. Opgehaald van pubs.acs.org.
- Amaro-Estrada, J.I., et al. (2013). Waterige oplossing van Hg (OH)twee: Energetische en dynamische dichtheid Functionele theorie Studies van de Hg (OH)twee-(H.tweeOF)n (n = 1-24) Structuren. J. Phys. Chem. A 2013, 117, 9069-9075. Opgehaald van pubs.acs.org.
- Inoue, Yoshikazu en Munemori, Makoto. (1979). Coprecipitatie van kwik (II) met ijzer (III) hydroxide. Milieuwetenschap en -technologie. Volume 13, nummer 4, april 1979. Hersteld van pubs.acs.org.
- Chang, L.W., et al. (2010). Zenuwstelsel en gedragstoxicologie. In uitgebreide toxicologie. Opgehaald van sciencedirect.com.
- Haney, Alan en Lipsey, Richard L. (1973). Accumulatie en effecten van methylkwikhydroxide in een terrestrische voedselketen onder laboratoriumomstandigheden. Environ. Vervuiling. (5) (1973) blz. 305-316. Opgehaald van sciencedirect.com.

Niemand heeft nog op dit artikel gereageerd.