
Formule van lithiumhydroxide (LiOH), eigenschappen, risico's, gebruik
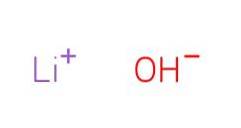
De lithiumhydroxide Het is een chemische verbinding met de formule LiOH (EMBL-EBI, 2008). Lithiumhydroxide is een anorganische basische verbinding. Het wordt grotendeels gebruikt in organische synthese om de reactie te bevorderen vanwege zijn sterke basiciteit.
Lithiumhydroxide komt niet vrij in de natuur voor. Het is erg reactief en als het in de natuur zou zijn, zou het gemakkelijk kunnen reageren om andere verbindingen te vormen. Sommige lithium / aluminiumhydroxiden die verschillende mengsels vormen, kunnen echter in verschillende mineralen worden aangetroffen..
In 1950 werd de Li-6-isotoop gebruikt als grondstof voor de productie van thermonucleaire wapens, zoals de waterstofbom..
Vanaf dat moment begon de atoomenergie-industrie in de Verenigde Staten een grote hoeveelheid lithiumhydroxide te gebruiken, wat leidde tot de verrassende ontwikkeling van de lithiumindustrie (Lithium hydroxide, 2016).
Het meeste lithiumhydroxide wordt geproduceerd door de reactie tussen lithiumcarbonaat en calciumhydroxide (Lythium hydroxide Formula, S.F.). Deze reactie produceert lithiumhydroxide en ook calciumcarbonaat:
LitweeCO3 + Ca (OH)twee → 2 LiOH + CaCO3
Het wordt ook bereid uit de reactie van lithiumoxide en water:
LitweeO + HtweeO → 2LiOH
Lithiumhydroxide werd gebruikt als kooldioxide-absorptiemiddelen in de onderzeeër en de opblaasbare bron van de legerballon in 1944.
Artikel index
- 1 Fysische en chemische eigenschappen
- 2 Reactiviteit en gevaren
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen
Lithiumhydroxide zijn witte kristallen zonder een karakteristiek aroma (National Center for Biotechnology Information., 2017). Het uiterlijk wordt getoond in figuur 2.

In waterige oplossing vormt het een kristallijne vloeistof met een scherp aroma. Het molecuulgewicht is 23,91 g / mol. Het bestaat in twee vormen: het watervrije en het monohydraat LiOH.H2O, dat een molecuulgewicht heeft van 41,96 g / mo. De verbinding heeft een dichtheid van 1,46 g / ml voor de watervrije vorm en 1,51 g / ml voor de monohydraatvorm..
Het smelt- en kookpunt is respectievelijk 462 ° C en 924 ° C. Lithiumhydroxide is het enige alkalische hydroxide dat geen polymorfisme vertoont, en het rooster heeft een tetragonale structuur. De verbinding is zeer oplosbaar in water en is slecht oplosbaar in ethanol (Royal Society of Chemistry, 2015).
Lithiumhydroxide en de andere alkalihydroxiden (NaOH, KOH, RbOH en CsOH) zijn zeer veelzijdig te gebruiken bij organische synthese omdat het sterkere basen zijn die gemakkelijk reageren..
Het kan bij kamertemperatuur reageren met water en kooldioxide. Het kan ook reageren met veel metalen zoals Ag, Au, Cu en Pt, dus het is een belangrijk uitgangsmateriaal geweest bij de organometaalsynthese..
Lithiumhydroxideoplossingen neutraliseren exotherm zuren om zouten plus water te vormen. Ze reageren met bepaalde metalen (zoals aluminium en zink) om oxiden of hydroxiden van het metaal te vormen en waterstofgas te genereren. Ze kunnen polymerisatiereacties initiëren in polymeriseerbare organische verbindingen, vooral epoxiden.
Het kan ontvlambare en / of giftige gassen genereren met ammoniumzouten, nitriden, gehalogeneerde organische verbindingen, verschillende metalen, peroxiden en hydroperoxiden. Kan als katalysator dienen.
Reageert bij verhitting boven ongeveer 84 ° C met waterige oplossingen van reducerende suikers anders dan sucrose, om toxische niveaus van koolmonoxide te ontwikkelen (CAMEO, 2016).
Reactiviteit en gevaren
Lithiumhydroxide is een stabiele verbinding, hoewel het niet compatibel is met sterke zuren, kooldioxide en vocht. De stof ontleedt bij verhitting (924 ° C) met vorming van giftige dampen.
De oplossing in water is een sterke base, reageert heftig met zuur en is corrosief voor aluminium en zink. Reageert met oxiderende stoffen.
De verbinding is bijtend voor de ogen, de huid, de luchtwegen en bij opname door de mond. Inademing van de stof kan longoedeem veroorzaken.
Symptomen van longoedeem verschijnen vaak enkele uren niet en worden verergerd door lichamelijke inspanning. Blootstelling kan dodelijk zijn. Effecten kunnen worden uitgesteld (National Institute for Occupational Safety and Health, 2015).
Als de verbinding in contact komt met de ogen, moeten de contactlenzen worden gecontroleerd en verwijderd. Ogen moeten onmiddellijk worden gespoeld met veel water gedurende tenminste 15 minuten met koud water.
In geval van contact met de huid, moet het getroffen gebied onmiddellijk gedurende minstens 15 minuten worden afgespoeld met veel water of een zwak zuur, bijvoorbeeld azijn, terwijl verontreinigde kleding en schoenen worden verwijderd..
Bedek geïrriteerde huid met een verzachtend middel. Was kleding en schoenen voordat u ze opnieuw gebruikt. Als het contact ernstig is, was dan met een desinfecterende zeep en bedek de besmette huid met een antibacteriële crème.
Bij inademing moet het slachtoffer naar een koele plaats worden verplaatst. Als de patiënt niet ademt, wordt kunstmatige beademing gegeven. Bij ademhalingsmoeilijkheden zuurstof toedienen.
Als de verbinding wordt ingeslikt, mag braken niet worden opgewekt. Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas.
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen (Veiligheidsinformatieblad Lithiumhydroxide, 21).
Toepassingen
Lithiumhydroxide wordt gebruikt bij de vervaardiging van lithiumzouten (zepen) van stearinezuur en andere vetzuren.
Deze zepen worden veel gebruikt als verdikkingsmiddelen in smeervetten om de hittebestendigheid, waterbestendigheid, stabiliteit en mechanische eigenschappen te verbeteren. Vetadditieven kunnen worden gebruikt in auto-, vliegtuig- en kraanlagers enz.
Gecalcineerd vast lithiumhydroxide kan worden gebruikt als kooldioxide-absorber voor bemanningsleden in ruimtevaartuigen en onderzeeërs.
Het ruimtevaartuig voor de Mercury-, Geminni- en Apollo-projecten van NASA gebruikte lithiumhydroxide als absorberende middelen. Het heeft een betrouwbare prestatie en kan gemakkelijk kooldioxide uit waterdamp absorberen. De chemische reactie is:
2LiOH + COtwee → LitweeCO3 + H.tweeOF.
1 g watervrije lithiumhydroxide kan koolstofdioxide absorberen met een volume van 450 ml. Slechts 750 g watervrij lithiumhydroxide kan de kooldioxide die elke dag door één persoon wordt uitgeademd, absorberen.
Lithiumhydroxide en andere lithiumverbindingen zijn onlangs gebruikt voor de ontwikkeling en studie van alkalinebatterijen (ENCYCLOPÆDIA BRITANNICA, 2013).
Referenties
- CAMEO. (2016). LITHIUMHYDROXIDE, OPLOSSING. Hersteld van cameochemicaliën.
- EMBL-EBI. (2008, 13 januari). lithiumhydroxide. Opgehaald van ChEBI.
- ENCYCLOPÆDIA BRITANNICA. (2013, 23 augustus). Lithium (Li). Opgehaald van britannica.
- Lithiumhydroxide. (2016). Opgehaald van chemicalbook.com.
- Lythiumhydroxide Formule. (S.F.). Opgehaald van softschools.com.
- Veiligheidsinformatieblad Lithiumhydroxide. (21, mei 2013). Opgehaald van sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie. (2017, 30 april). PubChem samengestelde database; CID = 3939. Opgehaald van PubChem.
- Nationaal instituut voor veiligheid en gezondheid op het werk. (2015, 22 juli). LITHIUMHYDROXIDE. Hersteld van cdc.gov.
- Royal Society of Chemistry. (2015). Lithiumhydroxide. Opgehaald van chemspider: chemspider.com.


Niemand heeft nog op dit artikel gereageerd.