
Ammoniumion (NH4 +) Formule, eigenschappen en toepassingen

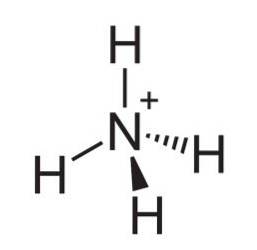
De ammoniumion is een positief geladen polyatomisch kation waarvan de chemische formule NH is4+. Het molecuul is niet plat, maar heeft de vorm van een tetraëder. De vier waterstofatomen vormen de vier hoeken.
Ammoniakstikstof heeft een ongedeeld elektronenpaar dat een proton kan accepteren (Lewis-base), daarom wordt het ammoniumion gevormd door de protonering van ammoniak volgens de reactie: NH3 + H.+ → NH4+
De naam ammonium wordt ook gegeven aan gesubstitueerde aminen of gesubstitueerde ammoniumkationen. Methylammoniumchloride is bijvoorbeeld een ionisch zout met de formule CH3NH4Cl waar het chloride-ion is gehecht aan een methylamine.
Het ammoniumion heeft eigenschappen die sterk lijken op de zwaardere alkalimetalen en wordt vaak als nauw verwant beschouwd. Ammonium zal zich naar verwachting gedragen als een metaal bij zeer hoge drukken, zoals in gasreuzenplaneten zoals Uranus en Neptunus..
Het ammoniumion speelt een belangrijke rol bij de eiwitsynthese in het menselijk lichaam. Kortom, alle levende wezens hebben eiwitten nodig, die zijn opgebouwd uit ongeveer 20 verschillende aminozuren. Hoewel planten en micro-organismen de meeste aminozuren uit stikstof in de atmosfeer kunnen synthetiseren, kunnen dieren dat niet..
Voor mensen kunnen sommige aminozuren helemaal niet worden gesynthetiseerd en moeten ze als essentiële aminozuren worden geconsumeerd.
Andere aminozuren kunnen echter worden gesynthetiseerd door micro-organismen in het maagdarmkanaal met behulp van ammoniakionen. Dit molecuul is dus een sleutelfiguur in de stikstofcyclus en bij de eiwitsynthese..
Artikel index
- 1 Eigenschappen
- 1.1 Oplosbaarheid en molecuulgewicht
- 1.2 Zuur-basiseigenschappen
- 1.3 Ammoniumzouten
- 2 toepassingen
- 3 referenties
Eigendommen
Oplosbaarheid en molecuulgewicht
Het ammoniumion heeft een molecuulgewicht van 18,039 g / mol en een oplosbaarheid van 10,2 mg / ml water (National Center for Biotechnology Information, 2017). Het oplossen van ammoniak in water vormt het ammoniumion volgens de reactie:
NH3 + H.tweeO → NH4+ + Oh-
Dit verhoogt de hydroxylconcentratie in het medium door de pH van de oplossing te verhogen (Royal Society of Chemistry, 2015).
Zure basiseigenschappen
Het ammoniumion heeft een pKb van 9,25. Dit betekent dat het bij een pH hoger dan deze waarde een zuurgedrag zal hebben en bij een lagere pH een basisch gedrag..
Bij het oplossen van ammoniak in azijnzuur (pKa = 4.76), neemt het vrije elektronenpaar van stikstof bijvoorbeeld een proton uit het medium, waardoor de concentratie van hydroxide-ionen toeneemt volgens de vergelijking:
NH3 + CH3COOH ⇌ NH4+ + CH3COO-
In aanwezigheid van een sterke base, zoals natriumhydroxide (pKa = 14,93), levert het ammoniumion een proton aan het medium volgens de reactie:
NH4+ + NaOH ⇌ NH3 + Na+ + H.tweeOF
Concluderend, bij een pH lager dan 9,25 zal stikstof geprotoneerd worden, terwijl het bij een pH hoger dan die waarde gedeprotoneerd zal worden. Dit is van het grootste belang voor het begrijpen van titratiecurves en het begrijpen van het gedrag van stoffen zoals aminozuren..
Ammoniumzouten
Een van de meest karakteristieke eigenschappen van ammoniak is het vermogen om direct met zuren te combineren om zouten te vormen, afhankelijk van de reactie:
NH3 + HX → NH4X
Zo vormt het met zoutzuur ammoniumchloride (NH4Cl); Met salpeterzuur, ammoniumnitraat (NH4NIET3), met koolzuur vormt het ammoniumcarbonaat ((NH4tweeCO3) enz.
Het is aangetoond dat perfect droge ammoniak niet zal combineren met perfect droog zoutzuur, aangezien het vocht nodig is om de reactie te veroorzaken (VIAS Encyclopedia, 2004).
De meeste eenvoudige ammoniumzouten zijn zeer goed oplosbaar in water. Een uitzondering is ammoniumhexachloorplatinaat, waarvan de vorming wordt gebruikt als test voor ammonium. De zouten van ammoniumnitraat en vooral perchloraat zijn zeer explosief, in deze gevallen is ammonium het reductiemiddel.
In een ongebruikelijk proces vormen de ammoniumionen een amalgaam. Dergelijke soorten worden bereid door elektrolyse van een ammoniumoplossing met behulp van een kwikkathode. Dit amalgaam ontleedt uiteindelijk om ammoniak en waterstof vrij te maken (Johnston, 2014).
Een van de meest voorkomende ammoniumzouten is ammoniumhydroxide, simpelweg ammoniak opgelost in water. Deze verbinding komt veel voor en komt van nature voor in het milieu (in lucht, water en bodem) en in alle planten en dieren, inclusief de mens..
Toepassingen
Ammonium is een belangrijke stikstofbron voor veel plantensoorten, vooral diegenen die groeien in hypoxische bodems. Het is echter ook giftig voor de meeste gewassoorten en wordt zelden toegepast als de enige bron van stikstof (Database, Human Metabolome, 2017).
Stikstof (N), gebonden aan eiwitten in dode biomassa, wordt verbruikt door micro-organismen en omgezet in ammoniumionen (NH4 +) die direct kunnen worden opgenomen door plantenwortels (bijv. Rijst).
Ammoniumionen worden meestal omgezet in nitrietionen (NO2-) door nitrosomonas-bacteriën, gevolgd door een tweede omzetting in nitraat (NO3-) door Nitrobacter-bacteriën..
De drie belangrijkste stikstofbronnen die in de landbouw worden gebruikt, zijn ureum, ammonium en nitraat. De biologische oxidatie van ammonium tot nitraat staat bekend als nitrificatie. Dit proces omvat verschillende stappen en wordt gemedieerd door obligate aërobe, autotrofe bacteriën..
In overstroomde bodems wordt de oxidatie van NH4 + beperkt. Ureum wordt afgebroken door het enzym urease of chemisch gehydrolyseerd tot ammoniak en CO2.
In de ammonificatiestap wordt de ammoniak door ammonificerende bacteriën omgezet in het ammoniumion (NH4 +). In de volgende stap wordt het ammonium door nitrificerende bacteriën omgezet in nitraat (nitrificatie).
Deze zeer mobiele vorm van stikstof wordt meestal opgenomen door plantenwortels, evenals door micro-organismen in de bodem..
Om de stikstofcyclus te sluiten, wordt stikstofgas in de atmosfeer omgezet in biomassastikstof door Rhizobium-bacteriën die leven in het wortelweefsel van peulvruchten (bijvoorbeeld alfalfa, erwten en bonen) en peulvruchten (zoals els). En door cyanobacteriën en Azotobacter (Sposito, 2011).
Door middel van ammonium (NH4 +) kunnen waterplanten stikstof opnemen en opnemen in eiwitten, aminozuren en andere moleculen. Hoge concentraties ammoniak kunnen de groei van algen en waterplanten bevorderen.
Ammoniumhydroxide en andere ammoniumzouten worden veel gebruikt in de voedselverwerking. De voorschriften van de Food and Drug Administration (FDA) stellen dat ammoniumhydroxide veilig is ("algemeen erkend als veilig" of GRAS) als gistmiddel, pH-regulerend middel en afwerkingsmiddel. Oppervlakkig in voedsel.
De lijst van voedingsmiddelen waarin ammoniumhydroxide wordt gebruikt als direct voedingsadditief is uitgebreid en omvat gebakken goederen, kazen, chocolaatjes, andere zoetwaren (bijv. Snoep) en puddingen. Ammoniumhydroxide wordt ook gebruikt als antimicrobieel middel in vleesproducten.
Ammoniak in andere vormen (bijv. Ammoniumsulfaat, ammoniumalginaat) wordt gebruikt in smaakmakers, soja-eiwitisolaten, snacks, jam en gelei en niet-alcoholische dranken (PNA-kaliumnitraatassociatie, 2016).
Ammoniummeting wordt gebruikt in de RAMBO-test, met name nuttig bij het diagnosticeren van de oorzaak van acidose (test-ID: RAMBO Ammonium, Random, Urine, S.F.). De nier reguleert de zuuruitscheiding en het systemische zuur-base-evenwicht.
Het veranderen van de hoeveelheid ammoniak in de urine is een belangrijke manier voor de nieren om dit te doen. Het meten van het ammoniakgehalte in de urine kan inzicht geven in de oorzaak van een zuur-base-evenwichtsstoornis bij patiënten..
Het ammoniakgehalte in de urine kan ook veel informatie geven over de dagelijkse zuurproductie bij een bepaalde patiënt. Aangezien het grootste deel van de zuurbelasting van een persoon afkomstig is van ingenomen eiwitten, is de hoeveelheid ammoniak in de urine een goede indicator voor de eiwitinname via de voeding..
Metingen van ammoniak in urine kunnen bijzonder nuttig zijn voor de diagnose en behandeling van patiënten met nierstenen:
- Hoge niveaus van ammoniak in de urine en een lage urine-pH duiden op aanhoudende gastro-intestinale verliezen. Deze patiënten lopen risico op urinezuur- en calciumoxalaatstenen..
- Een beetje ammoniak in de urine en een hoge pH van de urine duiden op renale tubulaire acidose. Deze patiënten lopen risico op calciumfosfaatstenen.
- Patiënten met calciumoxalaat- en calciumfosfaatstenen worden vaak behandeld met citraat om urinecitraat te verhogen (een natuurlijke remmer van calciumoxalaat- en calciumfosfaatkristalgroei)..
Omdat citraat echter wordt gemetaboliseerd tot bicarbonaat (een base), kan dit medicijn ook de pH van de urine verhogen. Als de pH van de urine bij citraatbehandeling te hoog is, kan het risico op calciumfosfaatstenen onbedoeld toenemen..
Het controleren van de urine op ammoniak is een manier om de citraatdosis te titreren en dit probleem te vermijden. Een goede startdosis citraat is ongeveer de helft van de ammoniumuitscheiding in de urine (in mEq van elk).
Het effect van deze dosis op ammonium-, citraat- en pH-waarden in de urine kan worden gevolgd en de citraatdosis kan worden aangepast op basis van de respons. Een daling van de ammoniak in de urine zou moeten aangeven of het huidige citraat voldoende is om de dagelijkse zuurbelasting van die gegeven patiënt gedeeltelijk (maar niet volledig) tegen te gaan..
Referenties
- Database, menselijk metaboloom. (2017, 2 maart). Metabocard voor Ammonium laten zien. Hersteld van: hmdb.ca.
- Johnston, F. J. (2014). Ammoniumzout. opgehaald van accessscience: accessscience.com.
- Nationaal centrum voor informatie over biotechnologie. (2017, 25 februari). PubChem samengestelde database; CID = 16741146. Opgehaald van PubChem.
- PNA kaliumnitraatassociatie. (2016). Nitraat (NO3-) versus ammonium (NH4 +). opgehaald van kno3.org.
- Royal Society of Chemistry. (2015). Ammonium-ion. Opgehaald van chemspider: chemspider.com.
- Sposito, G. (2011, 2 september). Bodem. Opgehaald van encyclopedie britannica: britannica.com.
- Test-ID: RAMBO Ammonium, Willekeurig, Urine. (S.F.). Opgehaald van encyclopediamayomedicallaboratorie.com.
- VIAS Encyclopedia. (2004, 22 december). Ammoniumzouten. Opgehaald van encyclopedia vias.org.



Niemand heeft nog op dit artikel gereageerd.