
Isobaire kenmerken, voorbeelden en verschillen met isotopen

De isobaren Het zijn die atomaire soorten die dezelfde massa hebben, maar die uit verschillende chemische elementen komen. Als gevolg hiervan kan worden gezegd dat ze zijn opgebouwd uit verschillende aantallen protonen en neutronen.
Zowel protonen als neutronen bevinden zich in de kern van hun atomen, maar het netto aantal neutronen en protonen in elke kern blijft hetzelfde. Met andere woorden, een isobaire soort ontstaat wanneer een paar atoomkernen hetzelfde netto aantal neutronen en protonen vertoont voor elke soort..
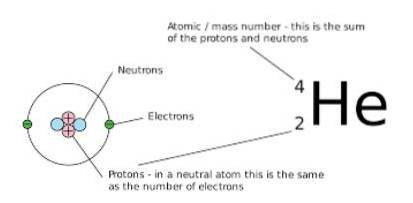
Het aantal neutronen en protonen waaruit die nettohoeveelheid bestaat, is echter verschillend. Een manier om het grafisch op te merken, is door het massagetal te observeren (dat linksboven op het symbool van het weergegeven chemische element staat), omdat dit getal in isobaren hetzelfde is.
Artikel index
- 1 Kenmerken
- 1.1 Vertegenwoordiging
- 2 voorbeelden
- 3 Verschillen tussen isobaren en isotopen
- 4 referenties
Kenmerken
In de eerste plaats komt de etymologie van de term isobarus uit de Griekse woorden isos (wat betekent "gelijk") en baros (wat betekent "gewicht"), wat verwijst naar de gelijkheid van gewichten tussen beide nucleaire soorten.
Opgemerkt moet worden dat isobaren bepaalde overeenkomsten hebben met andere soorten waarvan de kernen toevalligheden hebben, zoals isotonen, die hetzelfde aantal neutronen hebben maar met verschillende massagetallen en atoomnummers, zoals paren. 13C en 14Niet 36S en 37Cl.
Aan de andere kant is de term "nuclide" de naam die is bedacht voor elk van de sets nucleonen (structuren bestaande uit neutronen en protonen) die kunnen worden gevormd.
Zodat nucliden mogelijk worden onderscheiden door hun aantal neutronen of protonen, of zelfs door de hoeveelheid energie die de structuur van hun conglomeraat bezit..
Evenzo ontstaat er een dochterkern na het β-vervalproces en dit is op zijn beurt een isobaar van de moederkern, omdat het aantal nucleonen in de kern ongewijzigd blijft, in tegenstelling tot wat er gebeurt door middel van verval α.
Het is belangrijk om te onthouden dat verschillende isobaren verschillende atoomnummers hebben, wat bevestigt dat het verschillende chemische elementen zijn..
Vertegenwoordiging
Om de verschillende nucliden aan te duiden, wordt een specifieke notatie gebruikt, die op twee manieren kan worden weergegeven: de ene bestaat uit het plaatsen van de naam van het chemische element gevolgd door zijn massagetal, die zijn verbonden door een koppelteken. Bijvoorbeeld: stikstof-14, waarvan de kern bestaat uit zeven neutronen en zeven protonen.
De andere manier om deze soorten weer te geven, is door het symbool van het chemische element te plaatsen, voorafgegaan door een numeriek superscript dat het massagetal van het atoom in kwestie aangeeft, evenals een numeriek subscript dat het atoomnummer aangeeft, op de volgende manier:
ZNAARX
In deze uitdrukking staat X voor het chemische element van het betreffende atoom, A is het massagetal (resultaat van de optelling tussen het aantal neutronen en protonen) en Z staat voor het atoomnummer (gelijk aan het aantal protonen in de kern van de atoom).
Wanneer deze nucliden worden weergegeven, wordt het atoomnummer van het atoom (Z) meestal weggelaten omdat het geen relevante aanvullende gegevens oplevert, dus wordt het vaak weergegeven als NAARX.
Een manier om deze notatie te laten zien, is door het vorige voorbeeld (stikstof-14) te nemen, dat ook wordt aangeduid als 14N. Dit is de notatie die wordt gebruikt voor isobaren.
Voorbeelden
Het gebruik van de uitdrukking "isobaren" voor soorten die bekend staan als nucliden en die hetzelfde aantal nucleonen (gelijk massagetal) hebben, werd aan het einde van de jaren 1910 voorgesteld door de Britse chemicus Alfred Walter Stewart..
In deze volgorde van ideeën kan een voorbeeld van isobaren worden waargenomen in het geval van de soort 14C en 14N: het massagetal is gelijk aan 14, dit houdt in dat het aantal protonen en neutronen in beide soorten verschillend is.
Dit koolstofatoom heeft inderdaad een atoomnummer dat gelijk is aan 6, dus er zijn 6 protonen in zijn structuur en op zijn beurt heeft het 8 neutronen in zijn kern. Dus het massagetal is 14 (6 + 8 = 14).
Het stikstofatoom van zijn kant heeft een atoomnummer gelijk aan 7, dus het bestaat uit 7 protonen, maar het heeft ook 7 neutronen in zijn kern. Het massagetal is ook 14 (7 + 7 = 14).
Je kunt ook een reeks vinden waarin alle atomen een massagetal hebben dat gelijk is aan 40; dit is het geval bij isobaren: 40AC, 40K, 40Ar, 40Cl en 40S.
Verschillen tussen isobaren en isotopen
Zoals eerder uitgelegd, beschrijven nucliden de verschillende klassen van atoomkernen die bestaan, volgens het aantal protonen en neutronen dat ze hebben..
Tot deze typen nucliden behoren ook isobaren en isotopen, die hieronder zullen worden gedifferentieerd.
In het geval van isobaren, zoals eerder vermeld, hebben ze hetzelfde aantal nucleonen -dat wil zeggen, hetzelfde aantal massa-, waarbij het aantal protonen waarmee de ene soort groter is dan de andere overeenkomt met het aantal neutronen. hebben een tekort, dus het totaal is hetzelfde. Het atoomnummer is echter anders.
In die zin zijn isobarsoorten afkomstig van verschillende chemische elementen, dus bevinden ze zich in verschillende ruimtes van het periodiek systeem en hebben ze verschillende kenmerken en specifieke eigenschappen..
Aan de andere kant, in het geval van isotopen, gebeurt het tegenovergestelde, aangezien ze hetzelfde atoomnummer hebben maar verschillende hoeveelheden massa; dat wil zeggen, ze hebben hetzelfde aantal protonen maar een verschillend aantal neutronen in hun atoomkernen..
Bovendien zijn isotopen atomaire soorten die tot dezelfde elementen behoren, dus ze bevinden zich in dezelfde ruimte van het periodiek systeem en hebben vergelijkbare kenmerken en eigenschappen..
Referenties
- Wikipedia. (s.f.). Isobaar (nuclide). Opgehaald van en.wikipedia.org
- Britannica, E. (s.f.). Isobar. Opgehaald van britannica.com
- Konya, J. en Nagy, N. M. (2018). Nucleaire en radiochemie. Opgehaald van books.google.co.ve
- Energie-educatie. (s.f.). Isobar (nucleair). Opgehaald van energyeducation.ca
- Tutor View. (s.f.). Kernen. Hersteld van physics.tutorvista.com

Niemand heeft nog op dit artikel gereageerd.