
Koolstoftetrachloride (CCl4) structuur, eigenschappen, gebruik
De tetrachloorkoolstof het is een kleurloze vloeistof met een licht zoete geur, vergelijkbaar met de geur van ether en chloroform. De chemische formule is CCl4, en het vormt een covalente en vluchtige verbinding, waarvan de damp een grotere dichtheid heeft dan lucht; het is geen geleider van elektriciteit en het is ook niet brandbaar.
Het wordt aangetroffen in de atmosfeer, het rivierwater, de zee en sedimenten op het zeeoppervlak. Aangenomen wordt dat het koolstoftetrachloride dat aanwezig is in rode algen, door hetzelfde organisme wordt gesynthetiseerd.
In de atmosfeer wordt het geproduceerd door de reactie van chloor en methaan. Industrieel geproduceerd tetrachloorkoolstof komt in de oceaan terecht, voornamelijk via het grensvlak tussen zee en lucht. De atmosferische stroming => oceanisch wordt geschat op 1,4 x 1010 g / jaar, wat overeenkomt met 30% van de totale tetrachloorkoolstof in de atmosfeer.
Artikel index
- 1 Belangrijkste kenmerken
- 2 Structuur
- 3 Fysische en chemische eigenschappen
- 4 toepassingen
- 4.1 Chemische fabricage
- 4.2 Productie van koelmiddelen
- 4.3 Brandbestrijding
- 4.4 Reiniging
- 4.5 Chemische analyse
- 4.6 Infraroodspectroscopie en nucleaire magnetische resonantie
- 4.7 Oplosmiddel
- 4.8 Andere toepassingen
- 5 Toxiciteit
- 5.1 Hepatotoxische mechanismen
- 5.2 Giftige effecten op het nier- en centraal zenuwstelsel
- 5.3 Effecten van blootstelling bij mensen
- 5.4 Giftige interacties
- 6 Intermoleculaire interacties
- 7 referenties
Belangrijkste kenmerken
Koolstoftetrachloride wordt industrieel geproduceerd door thermische chlorering van methaan, waarbij methaan wordt omgezet met chloorgas bij een temperatuur tussen 400 ° C en 430 ° C. Tijdens de reactie ontstaat een ruw product met als bijproduct zoutzuur.
Het wordt ook industrieel geproduceerd met de koolstofdisulfidemethode. Chloor en koolstofdisulfide reageren bij een temperatuur van 90 ° C tot 100 ° C met ijzer als katalysator. Vervolgens wordt het ruwe product gefractioneerd, geneutraliseerd en gedestilleerd.
De CCl4 Het heeft meerdere toepassingen gehad, onder andere: oplosmiddel voor vetten, oliën, vernissen, enz .; chemisch reinigen van kleding; pesticiden, landbouw- en fungicidenontsmetting en nylonproductie. Ondanks zijn grote bruikbaarheid is het gebruik ervan echter gedeeltelijk verworpen vanwege de hoge toxiciteit die het met zich meebrengt..
Bij mensen veroorzaakt het toxische effecten op de huid, ogen en luchtwegen. Maar de meest schadelijke effecten treden op op de werking van het centrale zenuwstelsel, de lever en de nieren. Nierbeschadiging is misschien wel de belangrijkste doodsoorzaak die wordt toegeschreven aan de toxische werking van tetrachloorkoolstof.
Structuur
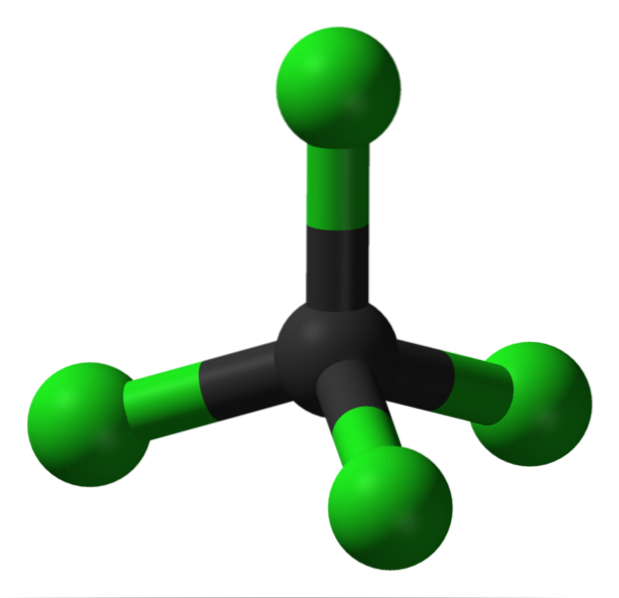
Op de afbeelding zie je de structuur van tetrachloorkoolstof, dat een tetraëdrische geometrie heeft. Merk op dat de Cl-atomen (de groene bollen) georiënteerd zijn in de ruimte rond de koolstof (zwarte bol) en een tetraëder tekenen.
Evenzo moet worden vermeld dat aangezien alle hoekpunten van de tetraëder identiek zijn, de structuur symmetrisch is; dat wil zeggen, ongeacht hoe het CCl-molecuul wordt geroteerd4, het zal altijd hetzelfde zijn. Dus sinds de groene tetraëder van CCl4 symmetrisch is, resulteert dit in de afwezigheid van een permanent dipoolmoment.
Waarom? Want hoewel de C-Cl-bindingen polair van aard zijn vanwege de grotere elektronegativiteit van Cl ten opzichte van C, heffen deze momenten op vectorly. Daarom is het een apolaire gechloreerde organische verbinding..
Koolstof is volledig gechloreerd in CCl4, wat gelijk staat aan hoge oxidatie (koolstof kan maximaal vier bindingen vormen met chloor). Dit oplosmiddel verliest niet de neiging elektronen te verliezen, is aprotisch (bevat geen waterstofatomen) en vormt een klein transport- en opslagmiddel voor chloor..
Fysische en chemische eigenschappen
Formule
CCl4
Molecuulgewicht
153,81 g / mol.
Fysiek uiterlijk
Het is een kleurloze vloeistof. Kristalliseert in de vorm van monokliene kristallen.
Geur
Het heeft de karakteristieke geur die aanwezig is in andere gechloreerde oplosmiddelen. De geur is aromatisch en enigszins zoet, vergelijkbaar met de geur van tetrachloorethyleen en chloroform.
Kookpunt
170,1 ºF (76,8 ºC) bij 760 mmHg.
Smeltpunt
-9ºF (-23ºC).
Oplosbaarheid in water
Het is slecht oplosbaar in water: 1,16 mg / ml bij 25 ºC en 0,8 mg / ml bij 20 ºC. Waarom? Omdat water, een sterk polair molecuul, geen affiniteit voelt voor tetrachloorkoolstof, dat niet-polair is..
Oplosbaarheid in organische oplosmiddelen
Vanwege de symmetrie van de moleculaire structuur is tetrachloorkoolstof een niet-polaire verbinding. Daarom is het mengbaar met alcohol, benzeen, chloroform, ether, koolstofdisulfide, petroleumether en nafta. Evenzo is het oplosbaar in ethanol en aceton..
Dichtheid
In vloeibare toestand: 1,59 g / ml bij 68 º F en 1,594 g / ml bij 20 ºC.
In vaste toestand: 1,831 g / ml bij -186 ºC en 1,809 g / ml bij -80 ºC.
Stabiliteit
Over het algemeen inert.
Bijtende werking
Tast sommige vormen van kunststoffen, rubbers en coatings aan.
ontstekingspunt
Het wordt als laag ontvlambaar beschouwd en geeft aan dat het ontstekingspunt lager is dan 982 ºC.
Automatische ontsteking
982 ºC (1800 º F; 1255 K).
Dampdichtheid
5.32 met betrekking tot lucht, genomen als een referentiewaarde gelijk aan 1.
Dampdruk
91 mmHg bij 68 ° F; 113 mmHg bij 77ºF en 115 mmHg bij 25ºC.
Ontleding
In aanwezigheid van vuur vormt het chloride en fosgeen, een zeer giftige verbinding. Evenzo ontleedt het onder dezelfde omstandigheden in waterstofchloride en koolmonoxide. In aanwezigheid van water met hoge temperaturen kan dit zoutzuur veroorzaken.
Viscositeit
2,03 x 10-3 Pa s
Geurdrempel
21,4 ppm.
Brekingsindex (ηD)
1.4607.
Toepassingen
Chemische fabricage
-Het grijpt in als chloreringsmiddel en / of oplosmiddel bij de productie van organisch chloor. Evenzo intervenieert het als monomeer bij de vervaardiging van nylon..
-Werkt als oplosmiddel bij de vervaardiging van rubbercement, zeep en insecticide.
-Het wordt gebruikt bij de vervaardiging van het drijfgas chloorfluorkoolwaterstof.
-Omdat het geen C-H-bindingen heeft, ondergaat tetrachloorkoolstof geen reacties van vrije radicalen, waardoor het een bruikbaar oplosmiddel is voor halogeneringen, hetzij door een elementair halogeen, hetzij door een halogeneringsreagens, zoals N-broomsuccinimide..
Koudemiddelproductie
Het werd gebruikt bij de productie van chloorfluorkoolstof, koelmiddel R-11 en trichloorfluormethaan, koelmiddel R-12. Deze koudemiddelen vernietigen de ozonlaag en daarom werd aanbevolen om het gebruik ervan stop te zetten, in overeenstemming met de aanbevelingen van het Montreal Protocol..
Brandbestrijding
Aan het begin van de 20e eeuw begon tetrachloorkoolstof te worden gebruikt als brandblusser, gebaseerd op een reeks eigenschappen van de verbinding: het is vluchtig; de damp is zwaarder dan lucht; het is geen elektrische geleider en is niet erg brandbaar.
Wanneer tetrachloorkoolstof wordt verhit, verandert het in een zware damp die de verbrandingsproducten bedekt, deze isoleert van de aanwezige zuurstof in de lucht, waardoor het vuur uitgaat. Het is geschikt voor het bestrijden van olie- en apparaatbranden.
Bij temperaturen hoger dan 500 ºC kan tetrachloorkoolstof echter reageren met water, waardoor fosgeen ontstaat, een giftige stof, dus tijdens gebruik moet op ventilatie worden gelet. Bovendien kan het explosief reageren met metallisch natrium, en het gebruik ervan bij branden met de aanwezigheid van dit metaal moet worden vermeden..
Schoonmaak
Tetrachloorkoolstof wordt al lang gebruikt bij het chemisch reinigen van kleding en andere huishoudelijke materialen. Daarnaast wordt het gebruikt als industriële metaalontvetter, uitstekend voor het oplossen van vet en olie.
Chemische analyse
Gebruikt voor de detectie van boor, bromide, chloride, molybdeen, wolfraam, vanadium, fosfor en zilver.
Infraroodspectroscopie en nucleaire magnetische resonantie
-Het wordt gebruikt als oplosmiddel bij infraroodspectroscopie, aangezien tetrachloorkoolstof geen significante absorptie heeft in banden> 1600 cm-1.
-Het werd gebruikt als oplosmiddel bij nucleaire magnetische resonantie, aangezien het de techniek niet verstoorde aangezien het geen waterstof bevatte (het is aprotisch). Maar vanwege de giftigheid en het lage oplossend vermogen is tetrachloorkoolstof vervangen door gedeutereerde oplosmiddelen..
Oplosmiddel
De eigenschap dat het een niet-polaire verbinding is, maakt het gebruik van tetrachloorkoolstof mogelijk als oplossingsmiddel voor oliën, vetten, lakken, vernissen, rubberwas en harsen. Het kan ook jodium oplossen.
Andere gebruiken
-Het is een belangrijk onderdeel van lavalampen, omdat tetrachloorkoolstof de was zwaarder maakt vanwege de dichtheid..
-Gebruikt door postzegelverzamelaars omdat het watermerken op postzegels onthult zonder schade te veroorzaken.
-Het is gebruikt als pesticide en fungicide middel en bij de begassing van granen om insecten te elimineren.
-Bij het snijden van metaal wordt het gebruikt als smeermiddel.
-Het is in de diergeneeskunde gebruikt als anthelminticum bij de behandeling van fasciolase, veroorzaakt door Fasciola hepatica bij schapen..
Toxiciteit
-Koolstoftetrachloride kan worden opgenomen via de luchtwegen, de spijsvertering, de ogen en de huid. Inslikken en inademen zijn erg gevaarlijk omdat ze op de lange termijn ernstige schade aan de hersenen, lever en nieren kunnen veroorzaken..
-Contact met de huid veroorzaakt irritatie en kan op lange termijn dermatitis veroorzaken. Terwijl contact met de ogen irritatie veroorzaakt.
Hepatotoxische mechanismen
De belangrijkste mechanismen die leverschade veroorzaken, zijn oxidatieve stress en verandering van calciumhomeostase.
Oxidatieve stress is een onbalans tussen de productie van reactieve zuurstofsoorten en het vermogen van het lichaam om in zijn cellen een reducerende omgeving te genereren die oxidatieve processen regelt..
De onbalans in de normale redoxtoestand kan toxische effecten veroorzaken door de productie van peroxiden en vrije radicalen die alle componenten van de cellen beschadigen..
Koolstoftetrachloride wordt gemetaboliseerd waarbij vrije radicalen ontstaan: Cl3C. (trichloormethylgroep) en Cl3COO. (trichloormethylperoxide radicaal). Deze vrije radicalen veroorzaken lipoperoxidatie, die schade aan de lever en ook de longen veroorzaakt.
Vrije radicalen veroorzaken ook de afbraak van het plasmamembraan van levercellen. Dit leidt tot een toename van de cytosolische calciumconcentratie en een afname van het intracellulaire mechanisme van calciumopslag..
Verhoogd intracellulair calcium activeert het enzym fosfolipase Atwee die inwerkt op fosfolipiden van het membraan, waardoor de aantasting ervan verergert. Bovendien is er infiltratie van neutrofielen en hepatocellulair letsel. Er is een afname van de cellulaire concentratie van ATP en glutathion die enzyminactivering en celdood veroorzaakt.
Giftige effecten op het nierstelsel en het centrale zenuwstelsel
De toxische effecten van tetrachloorkoolstof komen tot uiting in het renale systeem met een afname van de urineproductie en de ophoping van water in het lichaam. Vooral in de longen en een toename van de concentratie stofwisselingsafval in het bloed. Dit kan de dood tot gevolg hebben.
Op het niveau van het centrale zenuwstelsel is er sprake van axonale geleiding van zenuwimpulsen.
Effecten van blootstelling bij mensen
Korte duur
Oog irritatie; effecten op de lever, de nieren en het centrale zenuwstelsel, wat kan leiden tot bewustzijnsverlies.
Lange duur
Dermatitis en mogelijk kankerverwekkende werking.
Giftige interacties
Er is een verband tussen veel van de gevallen van vergiftiging met tetrachloorkoolstof en alcoholgebruik. Overmatig alcoholgebruik veroorzaakt leverschade, in sommige gevallen levercirrose.
Er is waargenomen dat de toxiciteit van tetrachloorkoolstof toeneemt met barbituraten, aangezien ze een aantal vergelijkbare toxische effecten hebben..
Op het niveau van de nieren verminderen barbituraten bijvoorbeeld de uitscheiding van urine, waarbij deze werking van barbituraten vergelijkbaar is met het toxische effect van tetrachloorkoolstof op de nierfunctie..
Intermoleculaire interacties
De CCl4 het kan worden beschouwd als een groene tetraëder. Hoe ga je om met anderen?
Omdat het een apolair molecuul is, zonder permanent dipoolmoment, kan het geen interactie vertonen via dipool-dipoolkrachten. Om hun moleculen in de vloeistof bij elkaar te houden, moeten de chlooratomen (de hoekpunten van de tetraëders) op de een of andere manier met elkaar in wisselwerking staan; en ze doen het dankzij de verspreidende krachten van Londen.
De elektronische wolken van Cl-atomen bewegen, en voor korte ogenblikken, genereren ze gebieden die rijk en arm zijn aan elektronen; dat wil zeggen, ze genereren ogenblikkelijke dipolen.
De δ-elektronenrijke zone zorgt ervoor dat het Cl-atoom van een naburig molecuul polariseert: Clδ- δ+Cl. Zo kunnen twee atomen van Cl voor een beperkte tijd bij elkaar worden gehouden..
Maar aangezien er miljoenen CCl-moleculen zijn4, de interacties worden effectief genoeg om onder normale omstandigheden een vloeistof te vormen.
Bovendien verhogen de vier Cl covalent gebonden aan elke C het aantal van deze interacties aanzienlijk; zo erg dat het kookt bij 76,8ºC, een hoog kookpunt.
Het kookpunt van CCl4 het kan niet hoger zijn omdat tetraëders relatief klein zijn in vergelijking met andere apolaire verbindingen (zoals xyleen, dat kookt bij 144 ° C).
Referenties
- Hardinger A. Steven. (2017). Geïllustreerde verklarende woordenlijst van organische chemie: tetrachloorkoolstof. Hersteld van: chem.ucla.edu
- Allemaal Siyavula. (s.f.). Intermoleculaire en interatomaire krachten. Hersteld van: siyavula.com
- Carey F. A. (2006). Organische chemie. (Zesde editie). Mc Graw Hill.
- Wikipedia. (2018). Koolstoftetrachloride. Hersteld van: en.wikipedia.org
- PubChem. (2018). Koolstoftetrachloride. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Chemisch boek. (2017). Koolstoftetrachloride. Hersteld van: chemicalbook.com



Niemand heeft nog op dit artikel gereageerd.