
Natriumlaurylsulfaatstructuur, toepassingen, eigenschappen

De natriumlaurylsulfaat is een organisch zout gevormd door de vereniging van het natriumion Na+ en het laurylsulfaation n-CelfH.2. 3CHtweeBEER3-. De chemische formule is CH3-(CHtwee10-CHtwee-BEER3-Na+. Het is ook bekend als natriumdodecylsulfaat omdat de koolwaterstofketen 12 koolstofatomen heeft. Het is een onderdeel van bubbelbadproducten.
Natriumlaurylsulfaat is een verbinding die inwerkt op het oppervlak dat zich tussen twee fasen bevindt, bijvoorbeeld tussen vloeistof en gas, of tussen water en olie. Dit maakt het in staat om als wasmiddel te werken, omdat het zich bindt aan olie- of vetdruppels of kleine porties vuil, en ze van het water scheidt in de vorm van een zwevend deeltje, dat vervolgens gemakkelijk kan worden afgespoeld..

Het dient ook als dispergeermiddel voor ingrediënten in voedingsproducten, waardoor hun textuur wordt verbeterd en wordt gebruikt in huisdierenshampoo omdat het vlooien en teken afstoot. Het werkt ook als een bevochtiger in diergeneesmiddelen en wordt gebruikt in de landbouw, verf, plastic en chemisch en biologisch onderzoek..
Er zijn onderzoeken die aangeven dat het de membranen die sommige virussen en bacteriën omringen, breekt en in sommige gevallen werkt als een antimicrobieel middel..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Soortelijk gewicht
- 3.5 Oplosbaarheid
- 3.6 Overige eigenschappen
- 3.7 Werkingsmechanisme als oppervlakteactieve stof
- 4 Verkrijgen
- 5 toepassingen
- 5.1 Bij het schoonmaken
- 5.2 In cosmetica
- 5.3 In de voedingsindustrie
- 5.4 Bij veterinaire toepassingen
- 5.5 In farmaceutische producten
- 5.6 In de geneeskunde
- 5.7 In verschillende toepassingen
- 5.8 In chemische en biologische onderzoekslaboratoria
- 5.9 In de olie-industrie
- 6 referenties
Structuur
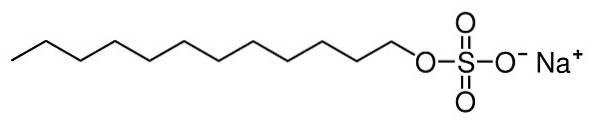
Natriumlaurylsulfaat of natriumdodecylsulfaat is een ionische organische verbinding gevormd door een natriumkation Na+ en een dodecylsulfaatanion n-CelfH.2. 3CHtweeBEER3-. De n in uw compacte formule om aan te geven dat het een rechte ketting is (onvertakt).
Het dodecylsulfaatanion heeft een lineaire koolwaterstofketen van 12 koolstofatomen gehecht aan een sulfaat -OSO3- door zuurstof, dus het heeft een enkele negatieve lading.
Nomenclatuur
- Natriumlaurylsulfaat
- Natriumdodecylsulfaat
- SLS Natriumlaurylsulfaat
Eigendommen
Fysieke toestand
Witte of crèmekleurige vaste stof in de vorm van kristallen, vlokken of poeder.
Molecuulgewicht
288,38 g / mol
Smeltpunt
205,5 ºC
Specifiek gewicht
Groter dan 1,1 bij 20 ºC
Oplosbaarheid
Het is matig oplosbaar in water: 15 g / 100 ml bij 20 ºC.
Andere eigenschappen
Natriumlaurylsulfaat is een ionische oppervlakteactieve stof of oppervlakteactieve stof. Dit betekent dat het een effect heeft op het oppervlak dat twee niet-mengbare fasen scheidt..
Het is een anionische oppervlakteactieve stof omdat het deel dat de oppervlakteactieve werking uitvoert het laurylsulfaatanion C iselfH.2. 3CHtweeBEER3- en niet natrium Na+.
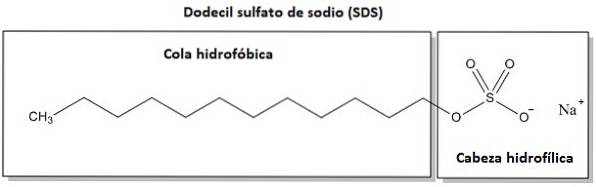
Het is een amfifiele verbinding, dit betekent dat een deel van het molecuul affiniteit heeft voor water (het is hydrofiel) en een ander deel heeft gelijkenis of aantrekking tot oliën en vetten en stoot water af (het is hydrofoob).
Het hydrofiele gedeelte is waar de negatieve lading van het anion wordt gevonden, dat wil zeggen de zuurstofatomen van de OSO-groep3- van het molecuul. De hydrofobe fractie is de koolwaterstofketen of CelfH.2. 3CHtwee-.
Het is gemakkelijk biologisch afbreekbaar en slechts zwak giftig.
Werkingsmechanisme als oppervlakteactieve stof
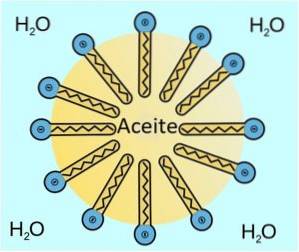
De actie die het als oppervlakteactieve stof uitvoert, is het wijzigen of veranderen van de oppervlaktespanning, vooral in waterige oplossingen. Hierdoor kun je vetten en oliën emulgeren.
Het werkingsmechanisme is dat het zich op het contactoppervlak tussen beide vloeistoffen bevindt, waar de oppervlaktespanning afneemt..
Om dit te doen, het hoofd of het hydrofiele deel OSO3- in contact wordt gebracht met water en de lijm of het hydrofobe deel CelfH.2. 3CHtwee- zit in de olie of het vet.
Het verkrijgen van
Het is onder meer afgeleid van kokos- of palmolie. Hieruit wordt laurylzuur verkregen, wat een vetzuur is. Dit ondergaat een reductieproces (het tegenovergestelde van oxidatie) om laurylalcohol te verkrijgen..
Om natriumlaurylsulfaat te verkrijgen, reageert laurylalcohol met zwavelzuur HtweeSW4 en laurylzuursulfaat wordt verkregen. Vervolgens wordt de laatste, die een zuur is, geneutraliseerd met natriumhydroxide NaOH.
n-CelfH.2. 3CHtweeOH (laurylalcohol) + HtweeSW4 n-CelfH.2. 3CHtweeBEER3H (zuur laurylsulfaat)
n-CelfH.2. 3CHtweeBEER3H + NaOH → n-CelfH.2. 3CHtweeBEER3-Na+ (natriumlaurylsulfaat)
Toepassingen
Vanwege zijn capaciteit als oppervlakteactieve stof of oppervlakteactieve stof, dient natriumlaurylsulfaat als detergent, emulgator, dispergeermiddel, bevochtigingsmiddel, enz..
Bij het schoonmaken
Het is een van de belangrijkste componenten van afwasmiddelen. Het is ook essentieel in tandpasta's of tandpasta, omdat het werkt bij de vorming van schuim, het hydrateert en verspreidt in deze en vele andere schoonmaakproducten..


In cosmetica
Het wordt onder meer gebruikt in lotions, shampoos, gels, bubbelbaden, zalfbases, crèmes en haarbleekmiddelen..

Hier zijn enkele van de andere toepassingen:
In de voedingsindustrie
Natriumdodecylsulfaat wordt zeer vaak gebruikt in de voedingsindustrie, bijvoorbeeld in pasta's en crèmes om een goede verspreiding van de ingrediënten mogelijk te maken, en in vruchtensappen, naast andere voedingsmiddelen.
Het werkt over het algemeen als een dispergeermiddel, emulgator en verdikkingsmiddel. Verbetert de textuur van bepaalde gebakken goederen. Verhoogt de stabiliteit en verlengt de houdbaarheid van voedsel.
In veterinaire toepassingen
Natriumlaurylsulfaat werkt als een vlooien- en tekenafweermiddel, daarom wordt het gebruikt in shampoo voor honden en katten..

Het dient ook als bevochtigingsmiddel in sommige antibiotica en antimicrobiële middelen voor orale of plaatselijke toediening (uitwendig gebruik) bij dieren. Het heeft toepassing in anthelmintica.
In farmaceutica
Natriumlaurylsulfaat heeft een brede toepassing in de farmaceutische industrie vanwege zijn oppervlakteactieve eigenschappen. Het werkt onder meer als emulgator, dispergeermiddel, bevochtiger.
Het heeft ook het kenmerk dat het werkt als een transportmiddel in verschillende medicijnen, bijvoorbeeld in die medicijnen die het gewenst is om door het mondslijmvlies te dringen..
In de geneeskunde
Sommige informatiebronnen melden dat natriumlaurylsulfaat een antivirale werking heeft tegen sommige virussen en bacteriën.
Het werkt bijvoorbeeld tegen het hiv-virus of het humaan immunodeficiëntievirus, tegen herpes simplex type 2 en tegen het humaan papillomavirus. Bovendien heeft het een microbicide werking tegen chlamydia.
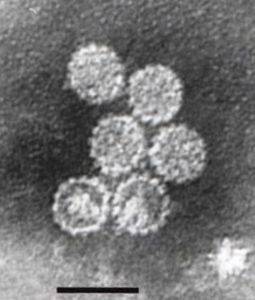
Zijn krachtige eiwitdenaturerende activiteit remt de infectieuze activiteit van virussen door de virale envelop op te lossen door deze te verstoren. Zijn microbicide activiteit werkt tegen sommige soorten omhulde en niet-omhulde virussen.
Natriumlaurylsulfaat is gebruikt bij de bereiding van bloedmonsters voor het aantal rode bloedcellen.
In verschillende toepassingen
- In de metallurgische industrie: bij het galvaniseren van metalen, vooral zink en nikkel.
- In de landbouw: als microbicide, fungicide, bactericide en als emulgator in insecticiden.
- In verven en verwijderingsmiddelen: als emulgator en penetrant in lakken, vernissen en verfafbijtmiddelen.
- In de kunststof- en rubberindustrie: als additief voor kunststoffen en latex. Verbetert de treksterkte van bepaalde polymeren. In emulsiepolymerisatie.
In raketbrandstoffen: als antischuimmiddel.
In chemische en biologische onderzoekslaboratoria
Natriumlaurylsulfaat dient als een onderzoeksinstrument in de biochemie. Het wordt veel gebruikt vanwege zijn vermogen om membranen van micro-organismen te verstoren of te verstoren.
Het vermogen om de structuur van weefsels te verstoren en de activiteit van bepaalde enzymen te remmen, leidt ertoe dat biochemici het gebruiken als een sleutelcomponent van veel van de reagentia die worden gebruikt om zuren uit de celkern te zuiveren, zoals RNA en DNA, of nucleïnezuren..
De membranen van micro-organismen bestaan voornamelijk uit eiwitten en lipiden (vetten). Omdat het een negatief geladen detergent is, adsorbeert of hecht natriumlaurylsulfaat sterk aan de eiwitstructuur, waardoor alle positieve ladingen worden geneutraliseerd. Het vormt dus interne hydrofobe associaties, waardoor elk eiwit dezelfde globale netto negatieve lading krijgt..
Dit is de reden waarom het wordt gebruikt bij de elektroforetische scheiding van eiwitten en lipiden, omdat omdat ze een negatieve lading hebben, eiwitten anders worden gemobiliseerd tegen een elektrisch veld..
Het wordt ook gebruikt om de relatieve sterkte van gluten in monsters van bloem of gemalen tarwe te bepalen. Gluten is een soort eiwit dat voorkomt in tarwe.
Glutendeeltjes worden gehydrateerd door natriumlaurylsulfaat en sediment. Hoe groter het sedimentvolume, hoe sterker de gluteneiwitten in het monster..
Natriumlaurylsulfaat wordt ook gebruikt bij de karakterisering van NH-quaternaire ammoniumverbindingen.4+. Het wordt ook gebruikt als referentie-oppervlakteactieve stof in toxiciteitstests voor water- en zoogdiersoorten..
In de olie-industrie
Natriumdodecylsulfaat wordt gebruikt als anti-emulgator bij de oliewinningstechniek door hydraulisch breken. hydraulisch fracken) van rotsformaties die hier rijk aan zijn. Dient om de vorming van emulsies in de breekvloeistof te voorkomen.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Natriumdodecylsulfaat. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Farrell Jr., R.E. (2010). Veerkrachtige ribonucleasen. Natriumdodecylsulfaat. In RNA Methodologies (Fourth Edition). Opgehaald van sciencedirect.com.
- Righetti, G. en Boschetti, E. (2013). Gedetailleerde methodologieën en protocollen. In eiwitarme ontdekking. Opgehaald van sciencedirect.com.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Vierde druk. John Wiley & Sons.
- (2016). Tarwe en meel testen. In Tarwemeel. Opgehaald van sciencedirect.com.
- Franz-Montan, M. et al .; (2017). Nanogestructureerde systemen voor transbuccale medicijnafgifte. In Nanostructures for Oral Medicine. Opgehaald van sciencedirect.



Niemand heeft nog op dit artikel gereageerd.