
De meeteenheden en het experiment van de wet van Avogadro
De De wet van Avogadro stelt dat een gelijk volume van alle gassen, bij dezelfde temperatuur en druk, hetzelfde aantal moleculen heeft. Amadeo Avogadro, een Italiaanse natuurkundige, stelde in 1811 twee hypothesen voor: de eerste zegt dat de atomen van elementaire gassen samen in moleculen zijn in plaats van als afzonderlijke atomen te bestaan, zoals John Dalton zei..
De tweede hypothese zegt dat gelijke volumes gassen bij constante druk en temperatuur hetzelfde aantal moleculen hebben. Avogadro's hypothese met betrekking tot het aantal moleculen in gassen werd pas in 1858 geaccepteerd, toen de Italiaanse chemicus Stanislao Cannizaro op basis hiervan een logisch chemisch systeem bouwde..

Uit de wet van Avogadro kan het volgende worden afgeleid: voor een gegeven massa van een ideaal gas zijn het volume en het aantal moleculen recht evenredig als de temperatuur en druk constant zijn. Dit houdt ook in dat het molaire volume van gassen die zich idealiter gedragen voor iedereen hetzelfde is.
Als u bijvoorbeeld een aantal ballonnen met het label A tot en met Z opgeeft, worden ze allemaal gevuld totdat ze zijn opgeblazen tot een volume van 5 liter. Elke letter komt overeen met een andere gasvormige soort; dat wil zeggen, zijn moleculen hebben hun eigen kenmerken. Volgens de wet van Avogadro bevatten alle ballonnen hetzelfde aantal moleculen.
Als de ballonnen nu zijn opgeblazen tot 10 liter, zal volgens de hypothesen van Avogadro tweemaal het aantal aanvankelijke gasvormige mollen zijn geïntroduceerd.
Artikel index
- 1 Waar het uit bestaat en meeteenheden
- 1.1 Aftrek van de waarde van R wanneer deze wordt uitgedrukt in L atm / K mol
- 2 Gebruikelijke vorm van de wet van Avogadro
- 3 Gevolgen en implicaties
- 4 Oorsprong
- 4.1 Avogadro's hypothese
- 4.2 Avogadro's nummer
- 5 Avogadro's experiment
- 5.1 Experimenteer met commerciële containers
- 6 voorbeelden
- 6.1 O2 + 2H2 => 2H2O
- 6.2 N2 + 3H2 => 2NH3
- 6,3 N2 + O2 => 2NO
- 7 referenties
Waar het uit bestaat en meeteenheden
De wet van Avogadro stelt dat, voor een massa van een ideaal gas, het volume van het gas en het aantal mol recht evenredig zijn als de temperatuur en druk constant zijn. Wiskundig kan het worden uitgedrukt met de volgende vergelijking:
V / n = K
V = volume van het gas, meestal uitgedrukt in liters.
n = hoeveelheid van de stof gemeten in mol.
Ook uit de zogenaamde ideale gaswet hebben we het volgende:
PV = nRT
P = gasdruk wordt meestal uitgedrukt in atmosfeer (atm), in mm kwik (mmHg) of in Pascal (Pa).
V = het volume van het gas uitgedrukt in liter (L).
n = aantal mol.
T = de temperatuur van het gas uitgedrukt in graden Celsius, graden Fahrenheit of graden Kelvin (0 ºC is gelijk aan 273,15K).
R = de universele constante van ideale gassen, die kan worden uitgedrukt in verschillende eenheden, waaronder de volgende opvallen: 0,08205 L atm / K. mol (L atm K-1.mol-18.314 J / K. mol (J.K-1.mol-1) (J is joule); en 1.987 cal / Kmol (cal.K-1.mol-1) (cal is calorieën).
Aftrek van de waarde van R uitgedrukt in LAtm / KMol
Het volume dat een mol gas inneemt bij een atmosfeer van druk en 0 ºC equivalent aan 273K is 22.414 liter.
R = PV / T
R = 1 atm x 22.414 (L / mol) / (273 ºK)
R = 0,082 L atm / mol.K
De ideale gasvergelijking (PV = nRT) kan als volgt worden geschreven:
V / n = RT / P
Als wordt aangenomen dat temperatuur en druk constant zijn, omdat R een constante is, dan:
RT / P = K
Later:
V / n = K
Dit is een gevolg van de wet van Avogadro: het bestaan van een constante relatie tussen het volume dat een ideaal gas inneemt en het aantal mol van dat gas, voor een constante temperatuur en druk..
Gebruikelijke vorm van de wet van Avogadro
Als u twee gassen heeft, wordt de bovenstaande vergelijking de volgende:
V.1/ n1= Vtwee/ ntwee
Deze uitdrukking wordt ook geschreven als:
V.1/ Vtwee= n1/ ntwee
Het bovenstaande toont de aangegeven proportionaliteitsrelatie.
In zijn hypothese wees Avogadro erop dat twee ideale gassen in hetzelfde volume en bij dezelfde temperatuur en druk hetzelfde aantal moleculen bevatten.
Bij uitbreiding geldt hetzelfde voor echte gassen; bijvoorbeeld een gelijk volume Otwee en Ntwee bevat hetzelfde aantal moleculen bij dezelfde temperatuur en druk.
Echte gassen vertonen kleine afwijkingen van ideaal gedrag. De wet van Avogadro is echter ongeveer geldig voor echte gassen bij voldoende lage druk en bij hoge temperaturen.
Gevolgen en implicaties
Het belangrijkste gevolg van de wet van Avogadro is dat de constante R voor ideale gassen dezelfde waarde heeft voor alle gassen.
R = PV / nT
Dus als R constant is voor twee gassen:
P.1V.1/ nT1= P.tweeV.twee/ ntweeTtwee = constant
Achtervoegsels 1 en 2 vertegenwoordigen twee verschillende ideale gassen. De conclusie is dat de ideale gasconstante voor 1 mol gas onafhankelijk is van de aard van het gas. Het volume dat door deze hoeveelheid gas wordt ingenomen bij een bepaalde temperatuur en druk, zal dan altijd hetzelfde zijn.
Een gevolg van de toepassing van de wet van Avogadro is de bevinding dat 1 mol gas een volume van 22.414 liter inneemt bij een druk van 1 atmosfeer en bij een temperatuur van 0 ºC (273K).
Een ander voor de hand liggend gevolg is het volgende: als druk en temperatuur constant zijn, neemt het volume ook toe als de hoeveelheid van een gas wordt verhoogd..
oorsprong
In 1811 kwam Avogadro met zijn hypothese op basis van de atoomtheorie van Dalton en de wet van Gay-Lussac over de bewegingsvectoren van moleculen..
Gay-Lussac concludeerde in 1809 dat "gassen, in welke verhoudingen ze ook kunnen worden gecombineerd, altijd verbindingen veroorzaken waarvan de in volume gemeten elementen altijd veelvouden zijn van een ander".
Dezelfde auteur toonde ook aan dat "gascombinaties altijd plaatsvinden volgens zeer eenvoudige volumeverhoudingen".
Avogadro wees erop dat bij chemische reacties in de gasfase moleculaire soorten van zowel reactanten als producten betrokken zijn.
Volgens deze verklaring moet de relatie tussen de reactant en de productmoleculen een geheel getal zijn, aangezien het niet waarschijnlijk is dat de binding wordt verbroken voorafgaand aan de reactie (individuele atomen). Molaire hoeveelheden kunnen echter worden uitgedrukt met fractionele waarden.
Van zijn kant geeft de wet van combinatievolumes aan dat de numerieke relatie tussen de gasvormige volumes ook eenvoudig en geheel getal is. Dit resulteert in een directe associatie tussen de volumes en het aantal moleculen van de gasvormige soort..
Avogadro-hypothese
Avogadro stelde voor dat gasmoleculen diatomisch waren. Dit verklaarde hoe twee volumes moleculaire waterstof worden gecombineerd met één volume moleculaire zuurstof om twee volumes water te geven..
Bovendien stelde Avogadro voor dat als gelijke volumes gassen hetzelfde aantal deeltjes bevatten, de relatie tussen de dichtheden van de gassen gelijk zou moeten zijn aan de relatie tussen de molecuulmassa's van deze deeltjes..
Het is duidelijk dat het delen van d1 door d2 leidt tot het quotiënt m1 / m2, aangezien het volume dat wordt ingenomen door de gasvormige massa's hetzelfde is voor beide soorten en het wordt geannuleerd:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Avogadro's nummer
Een mol bevat 6,022 x 102. 3 moleculen of atomen. Dit cijfer wordt het getal van Avogadro genoemd, hoewel hij niet degene was die het heeft berekend. Jean Pierre, Nobelprijswinnaar uit 1926, voerde de bijbehorende metingen uit en stelde de naam voor ter ere van Avogadro.
Avogadro's experiment
Een zeer eenvoudige demonstratie van de wet van Avogadro bestaat uit het plaatsen van azijnzuur in een glazen fles en vervolgens het toevoegen van natriumbicarbonaat, het sluiten van de opening van de fles met een ballon die het in- of uitstromen van gas uit de fles verhindert..
Azijnzuur reageert met natriumbicarbonaat, waardoor CO vrijkomttwee. Het gas hoopt zich op in de ballon waardoor deze wordt opgeblazen. Theoretisch is het volume dat de ballon bereikt evenredig met het aantal CO-moleculentwee, zoals bepaald door de wet van Avogadro.
Dit experiment heeft echter een beperking: de ballon is een elastisch lichaam; daarom, terwijl de wand zich uitstrekt vanwege de ophoping van COtwee, hierin wordt een kracht opgewekt die de uitzetting ervan tegenwerkt en probeert het volume van de ballon te verkleinen.
Experimenteer met commerciële containers
Een ander illustratief experiment van de wet van Avogadro wordt gepresenteerd met het gebruik van frisdrankblikjes en plastic flessen..
In het geval van blikjes frisdrank wordt er zuiveringszout in gegoten en vervolgens wordt een citroenzuuroplossing toegevoegd. De verbindingen reageren met elkaar waardoor er CO-gas vrijkomttwee, die zich ophoopt in het blik.
Vervolgens wordt een geconcentreerde natriumhydroxide-oplossing toegevoegd, die de functie heeft om de CO te "sekwestreren".twee. De toegang tot de binnenkant van het blik wordt dan snel afgesloten met afplaktape.
Na een bepaalde tijd wordt opgemerkt dat het blikje samentrekt, wat aangeeft dat de aanwezigheid van CO is afgenomen.twee. Dan zou je kunnen denken dat er een afname is in het volume van het blik die overeenkomt met een afname van het aantal CO-moleculen.twee, volgens de wet van Avogadro.
Bij het experiment met de fles wordt dezelfde procedure gevolgd als bij het frisdrankblikje, en wanneer de NaOH wordt toegevoegd, wordt de opening van de fles gesloten met het deksel; Evenzo wordt een samentrekking van de wand van de fles waargenomen. Als resultaat kan dezelfde analyse worden uitgevoerd als in het geval van het frisdrankblikje..
Voorbeelden
De drie onderstaande afbeeldingen illustreren het concept van de wet van Avogadro, die het volume dat gassen innemen en het aantal moleculen van reactanten en producten in verband brengt..
OFtwee + 2Htwee => 2HtweeOF
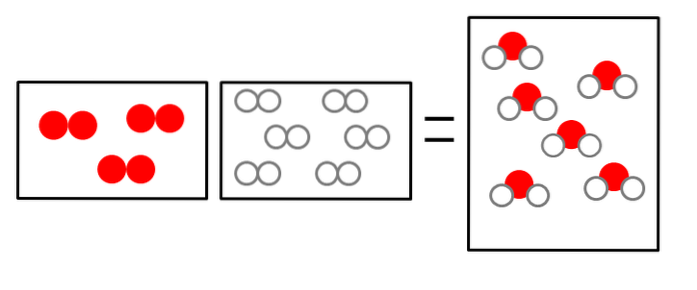
Het volume waterstofgas is dubbel, maar het neemt een container in die even groot is als dat van gasvormige zuurstof.
Ntwee + 3Htwee => 2NH3
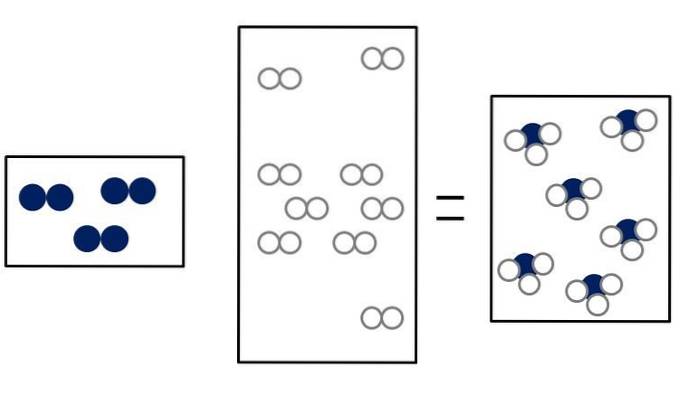
Ntwee + OFtwee => 2 NEE

Referenties
- Bernard Fernandez, PhD. (Februari 2009). Twee hypothesen van Avogadro (1811). [Pdf]. Ontleend aan: bibnum.education.fr
- Nuria Martínez Medina. (5 juli 2012). Avogadro, de grote Italiaanse wetenschapper uit de 19e eeuw. Genomen uit: rtve.es
- Muñoz R. en Bertomeu Sánchez J.R. (2003) The history of science in textbooks: Avogadro's hypothesis (s), Teaching science, 21 (1), 147-161.
- Helmenstine, Anne Marie, Ph.D. (1 februari 2018). Wat is de wet van Avogadro? Genomen van: thoughtco.com
- De redactie van Encyclopaedia Britannica. (2016, 26 oktober). De wet van Avogadro. Encyclopædia Britannica. Genomen uit: britannica.com
- Yang, S. P. (2002). Huishoudproducten die werden gebruikt om containers in te laten storten en de wet van Avogadro te demonstreren. Chem. Opvoeder. Deel: 7, pagina's: 37-39.
- Glasstone, S. (1968). Verdrag van fysische chemie. tweegeeft Ed. Redactioneel Aguilar.



Niemand heeft nog op dit artikel gereageerd.