
Wet van behoud van materie experimenten en voorbeelden

De wet van behoud van materie of massa Het is er een die vaststelt dat bij elke chemische reactie materie niet wordt gecreëerd of vernietigd. Deze wet is gebaseerd op het feit dat atomen ondeelbare deeltjes zijn in dit soort reacties; terwijl bij kernreacties atomen fragmenteren, daarom worden chemische reacties niet in overweging genomen.
Als de atomen niet worden vernietigd, moet het aantal atomen voor en na de reactie constant worden gehouden wanneer een element of verbinding reageert; wat zich vertaalt in een constante hoeveelheid massa tussen de betrokken reactanten en producten.
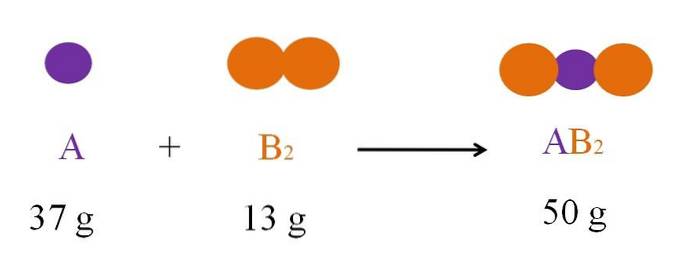
Dit is altijd het geval als er geen lek is waardoor materiaal verloren gaat; maar als de reactor hermetisch gesloten is, "verdwijnt" geen atoom, en daarom moet de geladen massa gelijk zijn aan de massa na de reactie.
Als het product daarentegen vast is, zal de massa gelijk zijn aan de som van de reactanten die bij de vorming betrokken zijn. Hetzelfde gebeurt met vloeibare of gasvormige producten, maar het is meer vatbaar voor fouten bij het meten van hun resulterende massa..
Deze wet is ontstaan uit experimenten in de afgelopen eeuwen en werd versterkt door de bijdragen van verschillende beroemde chemici, zoals Antoine Lavoisier..
Beschouw de reactie tussen A en Btwee om AB te vormentwee (bovenste afbeelding). Volgens de wet van behoud van materie is de massa van ABtwee moet gelijk zijn aan de som van de massa's van A en Btwee, respectievelijk. Dus als 37 g A reageert met 13 g Btwee, product ABtwee moet 50 g wegen.
Daarom is in een chemische vergelijking de massa van de reactanten (A en Btwee) moet altijd gelijk zijn aan de massa van de producten (ABtwee.
Een voorbeeld dat sterk lijkt op het zojuist beschreven voorbeeld is dat van de vorming van metaaloxiden, zoals roest of roest. Roest is zwaarder dan ijzer (hoewel het er misschien niet zo uitziet) omdat het metaal reageerde met een massa zuurstof om het oxide te genereren.
Artikel index
- 1 Wat is de wet van behoud van materie of massa??
- 1.1 Lavoisier's bijdrage
- 2 Hoe wordt deze wet toegepast in een chemische vergelijking?
- 2.1 Basisprincipes
- 2.2 Chemische vergelijking
- 3 Experimenten die de wet bewijzen
- 3.1 Verbranding van metalen
- 3.2 Afgifte van zuurstof
- 4 voorbeelden (praktische oefeningen)
- 4.1 Afbraak van kwikmonoxide
- 4.2 Verbranding van een magnesiumtape
- 4.3 Calciumhydroxide
- 4.4 Koperoxide
- 4.5 Vorming van natriumchloride
- 5 referenties
Wat is de wet van behoud van materie of massa??
Deze wet stelt dat bij een chemische reactie de massa van de reactanten gelijk is aan de massa van de producten. De wet wordt uitgedrukt in de zin "materie wordt niet gecreëerd of vernietigd, alles wordt getransformeerd", zoals het werd verkondigd door Julius Von Mayer (1814-1878).
De wet werd onafhankelijk ontwikkeld door Michail Lamanosov, in 1745, en door Antoine Lavoisier in 1785. Hoewel Lamanosovs onderzoek naar de wet van het behoud van de mis dateert van vóór die van Lavoisier, waren ze in Europa niet bekend omdat ze in het Russisch waren geschreven..
De experimenten die in 1676 door Robert Boyle werden uitgevoerd, brachten hen ertoe erop te wijzen dat wanneer een materiaal in een open container werd verbrand, het materiaal in gewicht toenam; misschien als gevolg van een transformatie die door het materiaal zelf wordt ervaren.
Lavoiser's experimenten met het verbranden van materialen in containers met beperkte luchtinlaat lieten een gewichtstoename zien. Dit resultaat was in overeenstemming met dat van Boyle.
Lavoisier's bijdrage
De conclusie van Lavoisier was echter anders. Hij dacht dat tijdens verbranding een hoeveelheid massa uit de lucht werd gehaald, wat de toename in massa zou verklaren die werd waargenomen in de materialen die aan verbranding werden onderworpen..
Lavoiser dacht dat de massa van metalen constant bleef tijdens verbranding, en dat de afname van verbranding in gesloten containers niet werd veroorzaakt door een afname van een losse (niet meer gebruikte concept), een veronderstelde essentie gerelateerd aan de productie van warmte..
Lavoiser wees erop dat de waargenomen afname eerder werd veroorzaakt door een afname van de concentratie van de gassen in de gesloten containers..
Hoe wordt deze wet toegepast in een chemische vergelijking??
De wet van behoud van massa is van transcendentaal belang in stoichiometrie, waarbij de laatste wordt gedefinieerd als de berekening van de kwantitatieve relaties tussen reactanten en producten die aanwezig zijn in een chemische reactie..
De principes van stoichiometrie werden in 1792 verkondigd door Jeremías Benjamin Richter (1762-1807), die het definieerde als de wetenschap die de kwantitatieve verhoudingen of massaverhoudingen meet van de chemische elementen die bij een reactie betrokken zijn..
Bij een chemische reactie is er een wijziging van de stoffen die eraan deelnemen. Opgemerkt wordt dat de reactanten of reactanten worden verbruikt om de producten te laten ontstaan.
Tijdens de chemische reactie zijn er verbrekingen van bindingen tussen de atomen, evenals de vorming van nieuwe bindingen; maar het aantal atomen dat bij de reactie betrokken is, blijft ongewijzigd. Dit is wat bekend staat als de wet van behoud van materie.
Basisprincipes
Deze wet impliceert twee basisprincipes:
-Het totale aantal atomen van elk type is gelijk in de reactanten (vóór de reactie) en in de producten (na de reactie).
-De som van de elektrische ladingen voor en na de reactie blijft constant.
Dit komt doordat het aantal subatomaire deeltjes constant blijft. Deze deeltjes zijn neutronen zonder elektrische lading, positief geladen protonen (+) en negatief geladen elektronen (-). De elektrische lading verandert dus niet tijdens een reactie.
Reactievergelijking
Dit gezegd hebbende, bij het weergeven van een chemische reactie door middel van een vergelijking (zoals die in de hoofdafbeelding), moeten de basisprincipes worden gerespecteerd. De chemische vergelijking maakt gebruik van symbolen of representaties van de verschillende elementen of atomen, en hoe ze voor of na de reactie in moleculen zijn gegroepeerd.
De volgende vergelijking wordt opnieuw als voorbeeld gebruikt:
A + Btwee => ABtwee
Het subscript is een nummer dat aan de rechterkant van de elementen wordt geplaatst (Btwee en ABtwee) in het onderste deel, waarmee het aantal atomen van een element in een molecuul wordt aangegeven. Dit aantal kan niet worden gewijzigd zonder de productie van een nieuw molecuul, anders dan het oorspronkelijke..
De stoichiometrische coëfficiënt (1, in het geval van A en de rest van de soort) is een getal dat aan de linkerkant van de atomen of moleculen is geplaatst, een indicatie van het aantal dat bij een reactie betrokken is.
In een chemische vergelijking wordt, als de reactie onomkeerbaar is, een enkele pijl geplaatst die de richting van de reactie aangeeft. Als de reactie omkeerbaar is, zijn er twee pijlen in de tegenovergestelde richting. Links van de pijlen staan de reagentia of reactanten (A en Btwee), terwijl aan de rechterkant de producten (ABtwee.
Swingen
Het balanceren van een chemische vergelijking is een procedure die het mogelijk maakt om het aantal atomen van de chemische elementen in de reactanten gelijk te stellen aan die van de producten.
Met andere woorden, het aantal atomen van elk element moet hetzelfde zijn aan de reactantenzijde (vóór de pijl) en aan de reactieproductenzijde (na de pijl).
Er wordt gezegd dat wanneer een reactie in evenwicht is, de wet van massa-actie wordt gerespecteerd.
Daarom is het essentieel om het aantal atomen en de elektrische ladingen aan beide zijden van de pijl in een chemische vergelijking in evenwicht te brengen. Evenzo moet de som van de massa's van de reactanten gelijk zijn aan de som van de massa's van de producten.
Voor het geval van de weergegeven vergelijking is deze al in evenwicht (gelijk aantal A en B aan beide zijden van de pijl).
Experimenten die de wet bewijzen
Metaalverbranding
Lavoiser, die de verbranding van metalen zoals lood en tin observeerde in gesloten containers met een beperkte aanzuiging van lucht, merkte op dat de metalen bedekt waren met een calcinering; en verder dat het gewicht van het metaal op een bepaald moment van verhitting gelijk was aan het begin.
Aangezien een gewichtstoename wordt waargenomen bij het verbranden van een metaal, dacht Lavoiser dat het waargenomen overgewicht verklaard zou kunnen worden door een bepaalde massa van iets dat tijdens de verbranding uit de lucht wordt gehaald. Om deze reden bleef de massa constant.
Deze conclusie, die met een ondeugdelijke wetenschappelijke basis kan worden beschouwd, is niet zo, rekening houdend met de kennis die Lavoiser had over het bestaan van zuurstof op het moment dat hij zijn wet uitsprak (1785).
Afgifte van zuurstof
Zuurstof werd ontdekt door Carl Willhelm Scheele in 1772. Later ontdekte Joseph Priesley het onafhankelijk en publiceerde hij de resultaten van zijn onderzoek, drie jaar voordat Scheele zijn resultaten over hetzelfde gas publiceerde..
Priesley verwarmde kwikmonoxide en verzamelde een gas dat de helderheid van de vlam verhoogde. Bovendien werden ze actiever toen de muizen in een bak met het gas werden geplaatst. Priesley noemde dit gedeflogistisch gas.
Priesley rapporteerde zijn waarnemingen aan Antoine Lavoiser (1775), die zijn experimenten herhaalde en aantoonde dat gas in lucht en in water werd aangetroffen. Lavoiser herkende gas als een nieuw element en noemde het zuurstof.
Toen Lavoisier als argument gebruikte om zijn wet vast te stellen, dat de overtollige massa die werd waargenomen bij de verbranding van metalen het gevolg was van iets dat uit de lucht werd gehaald, dacht hij aan zuurstof, een element dat zich combineert met metalen tijdens verbranding..
Voorbeelden (praktische oefeningen)
Ontleding van kwikmonoxide
Als 232,6 kwikmonoxide (HgO) wordt verwarmd, valt het uiteen in kwik (Hg) en moleculaire zuurstof (OtweeOp basis van de wet van behoud van massa en de atoomgewichten: (Hg = 206,6 g / mol) en (O = 16 g / mol), geef de massa van Hg en Otwee dat wordt gevormd.
HgO => Hg + Otwee
232,6 g 206,6 g 32 g
De berekeningen zijn heel eenvoudig, aangezien precies één mol HgO wordt afgebroken.
Verbranding van een magnesiumband

Een magnesiumlint van 1,2 g werd verbrand in een gesloten container met daarin 4 g zuurstof. Na de reactie bleef 3,2 g niet-omgezette zuurstof over. Hoeveel magnesiumoxide is er gevormd?
Het eerste dat moet worden berekend, is de massa zuurstof die reageerde. Dit kan eenvoudig worden berekend met behulp van een aftrekking:
Massa van Otwee die reageerde = initiële massa van Otwee - eindmassa van Otwee
(4 - 3.2) g Otwee
0,8 g Otwee
Op basis van de wet van behoud van massa kan de massa van gevormd MgO worden berekend.
Massa van MgO = massa van Mg + massa van O
1,2 g + 0,8 g
2,0 g MgO
Calcium hydroxide
Een massa van 14 g calciumoxide (CaO) reageerde met 3,6 g water (H.tweeO), die volledig werd verbruikt in de reactie om 14,8 g calciumhydroxide, Ca (OH) te vormentwee
Hoeveel calciumoxide reageerde om calciumhydroxide te vormen?
Hoeveel calciumoxide was er nog over?
De reactie kan worden geschetst door de volgende vergelijking:
CaO + HtweeO => Ca (OH)twee
De vergelijking is in evenwicht. Daarom voldoet het aan de wet van behoud van massa.
Massa van CaO betrokken bij de reactie = massa van Ca (OH)twee - massa van HtweeOF
14,8 g - 3,6 g
11,2 g CaO
Daarom wordt de CaO die niet reageerde (degene die overblijft) berekend door een aftrekking uit te voeren:
Massa overmaat CaO = massa aanwezig in de reactie - massa die deelnam aan de reactie.
14 g CaO - 11,2 g CaO
2,8 g CaO
Koperoxide
Hoeveel koperoxide (CuO) wordt er gevormd als 11 g koper (Cu) volledig reageert met zuurstof (OtweeHoeveel zuurstof is er nodig bij de reactie?
De eerste stap is om de vergelijking in evenwicht te brengen. De gebalanceerde vergelijking is als volgt:
2Cu + Otwee => 2CuO
De vergelijking is evenwichtig, dus het voldoet aan de wet van behoud van massa.
Het atoomgewicht van Cu is 63,5 g / mol en het molecuulgewicht van CuO is 79,5 g / mol..
Het is noodzakelijk om te bepalen hoeveel CuO wordt gevormd door de volledige oxidatie van de 11 g Cu:
CuO massa = (11 g Cu) ∙ (1 mol Cu / 63,5 g Cu) ∙ (2 mol CuO / 2 mol Cu) ∙ (79,5 g CuO / mol CuO)
Massa van gevormd CuO = 13,77 g
Daarom geeft het verschil in massa tussen CuO en Cu de hoeveelheid zuurstof die bij de reactie is betrokken:
Massa zuurstof = 13,77 g - 11 g
1,77 g Otwee
Vorming van natriumchloride
Een massa chloor (Cltwee) van 2,47 g werd omgezet met voldoende natrium (Na) en 3,82 g natriumchloride (NaCl) werd gevormd. Hoeveel Na reageerde?
Evenwichtige vergelijking:
2Na + Cltwee => 2NaCl
Volgens de wet van behoud van massa:
Massa van Na = massa van NaCl - massa Cltwee
3,82 g - 2,47 g
1,35 g Na
Referenties
- Flores, J. Química (2002). Redactioneel Santillana.
- Wikipedia. (2018). Wet van behoud van materie. Hersteld van: es.wikipedia.org
- Nationaal Polytechnisch Instituut. (s.f.). Wet van behoud van massa. CGFIE. Hersteld van: aev.cgfie.ipn.mx
- Helmenstine, Anne Marie, Ph.D. (18 januari 2019). Wet van behoud van massa. Hersteld van: thoughtco.com
- Shrestha B. (18 november 2018). De wet van behoud van materie. Chemie LibreTexts. Hersteld van: chem.libretexts.org



Niemand heeft nog op dit artikel gereageerd.