
Atomaire massa-definitie, typen, hoe deze te berekenen, voorbeelden

De atoom massa is de hoeveelheid materie die aanwezig is in een atoom, die kan worden uitgedrukt in gewone fysieke eenheden of in atomaire massa-eenheden (uma of u). Een atoom is grotendeels leeg; elektronen die worden verspreid in gebieden die orbitalen worden genoemd, waar er een zekere kans is om ze te vinden, en hun kern.
Protonen en neutronen worden gevonden in de kern van het atoom; de eerste met positieve ladingen, terwijl de laatste met neutrale ladingen. Deze twee subatomaire deeltjes hebben een massa die veel groter is dan die van het elektron; Daarom wordt de massa van een atoom bepaald door zijn kern en niet door het vacuüm of de elektronen.
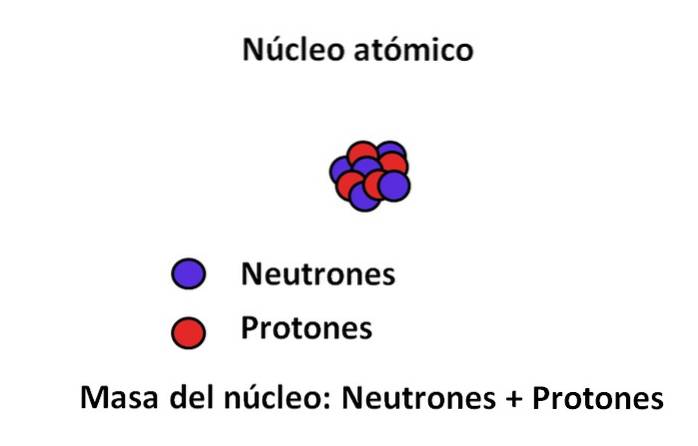
De massa van een elektron is ongeveer 9.110-31 kg, terwijl dat van het proton 1,67 · 10-27 kg, met een massaverhouding van 1.800; dat wil zeggen, een proton "weegt" 1800 keer meer dan een elektron. Evenzo gebeurt hetzelfde met de massa's van het neutron en elektron. Daarom wordt de massabijdrage van het elektron voor gewone doeleinden als verwaarloosbaar beschouwd..
Daarom wordt vaak aangenomen dat de massa van het atoom, of de atoommassa, alleen afhangt van de massa van de kern; die op zijn beurt bestaat uit de som van de materie van de neutronen en protonen. Uit deze redenering komen twee concepten naar voren: massagetal en atomaire massa, beide nauw verwant..
Er is zoveel "vacuüm" in de atomen, en aangezien hun massa bijna volledig een functie is van de kern, is het te verwachten dat deze buitengewoon dicht is..
Als we die leegte van een lichaam of object verwijderen, zouden de afmetingen drastisch krimpen. En als we een klein object zouden kunnen bouwen op basis van atoomkernen (zonder elektronen), dan zou het een massa van miljoenen tonnen hebben..
Aan de andere kant helpen atoommassa's om verschillende atomen van hetzelfde element te onderscheiden; dit zijn de isotopen. Aangezien er isotopen overvloediger zijn dan andere, moet een gemiddelde van de massa van de atomen voor een bepaald element worden geschat; gemiddelde dat kan variëren van planeet tot planeet, of van het ene ruimtelijke gebied tot het andere.
Artikel index
- 1 Definitie en concept
- 1.1 Atomaire massa-eenheid
- 1.2 Gelijkwaardigheid in gram
- 2 Gemiddelde atomaire massa
- 2.1 Voorbeeld
- 3 Absolute atomaire massa
- 4 Relatieve atomaire massa
- 5 Hoe atomaire massa te berekenen
- 6 voorbeelden
- 6.1 Koolstof
- 6.2 Natrium
- 6.3 Zuurstof
- 6.4 Stikstof
- 6.5 Chloor
- 6.6 Dysprosium
- 7 referenties
Definitie en concept
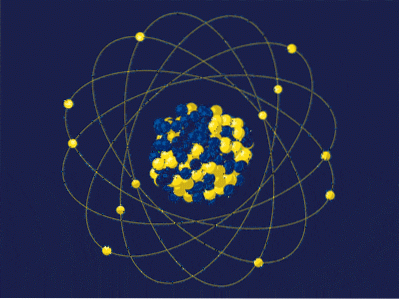
Per definitie is de atoommassa de som van de massa's van zijn protonen en neutronen uitgedrukt met uma of u. Het resulterende getal (ook wel massagetal genoemd) wordt dimensieloos in de linkerbovenhoek geplaatst in de notatie die wordt gebruikt voor nucliden. Bijvoorbeeld voor het element vijftienX zijn atoommassa is 15uma of 15u.
De atoommassa kan niet veel zeggen over de ware identiteit van dit element X. In plaats daarvan wordt het atoomnummer gebruikt, dat overeenkomt met de protonen in de kern van X. Als dit aantal 7 is, dan is het verschil (15-7) gelijk aan 8; dat wil zeggen, X heeft 7 protonen en 8 neutronen, waarvan de som 15 is.
Terugkerend naar de afbeelding, heeft de kern 5 neutronen en 4 protonen, dus het massagetal is 9; en op zijn beurt is 9 amu de massa van zijn atoom. Door 4 protonen te hebben en het periodiek systeem te raadplegen, kan worden gezien dat deze kern overeenkomt met die van het element beryllium, Be (of 9Worden).
Atomaire massa-eenheid
Atomen zijn te klein om hun massa te kunnen meten met conventionele methoden of gewone balansen. Om deze reden is de uma, u of Da (kleurenblind) uitgevonden. Deze eenheden die voor atomen zijn ontworpen, geven je een idee van hoe massief de atomen van een element zijn in relatie tot elkaar..
Maar wat stelt een amu precies voor? Er moet een referentie zijn waarmee massale relaties tot stand kunnen worden gebracht. Hiervoor werd het atoom als referentie gebruikt 12C, de meest voorkomende en stabiele isotoop voor koolstof. Met 6 protonen (het atoomnummer Z) en 6 neutronen, is de atoommassa daarom 12.
Aangenomen wordt dat protonen en neutronen dezelfde massa hebben, zodat elk 1 amu bijdraagt. De atomaire massa-eenheid wordt dan gedefinieerd als een twaalfde (1/12) van de massa van een koolstof-12-atoom; dit is de massa van een proton of neutron.
Gelijkwaardigheid in gram
En nu rijst de vraag: hoeveel gram is 1 amu gelijk? Omdat er aanvankelijk niet voldoende geavanceerde technieken waren om het te meten, moesten scheikundigen genoegen nemen met het uitdrukken van alle massa's met amu; dit was echter een voordeel en geen nadeel.
Waarom? Omdat subatomaire deeltjes zo klein zijn, moet hun massa, uitgedrukt in gram, net zo klein zijn geweest. In feite is 1 amu gelijk aan 1,6605.10-24 gram. Bovendien was het met het gebruik van het concept van mol geen probleem om de massa's van de elementen en hun isotopen met amu te bewerken, wetende dat dergelijke eenheden konden worden gewijzigd in g / mol.
Ga bijvoorbeeld terug naar vijftienX en 9Wees, we hebben dat hun atoommassa's respectievelijk 15 amu en 9 amu zijn. Omdat deze eenheden zo klein zijn en niet direct vertellen hoeveel materie men moet 'wegen' om ze te manipuleren, worden ze omgezet in hun respectievelijke molaire massa: 15 g / mol en 9 g / mol (waarbij de begrippen mollen en het getal van Avogadro ).
Gemiddelde atomaire massa
Niet alle atomen van hetzelfde element hebben dezelfde massa. Dit betekent dat ze meer subatomaire deeltjes in de kern moeten hebben. Omdat het hetzelfde element is, moet het atoomnummer of aantal protonen constant blijven; daarom is er alleen variatie in de hoeveelheid neutronen die ze bezitten.
Dit is hoe het blijkt uit de definitie van isotopen: atomen van hetzelfde element maar met verschillende atoommassa's. Beryllium bestaat bijvoorbeeld bijna volledig uit de isotoop 9Wees, met sporen van 10Worden. Dit voorbeeld is echter niet erg behulpzaam bij het begrijpen van het concept van gemiddelde atoommassa; we hebben er een nodig met meer isotopen.
Voorbeeld
Stel dat het element bestaat 88J, dit is de belangrijkste isotoop van J met een overvloed van 60%. J heeft ook twee andere isotopen: 86J, met een overvloed van 20%, en 90J, met een overvloed ook van 20%. Dit betekent dat van de 100 J-atomen die we op aarde verzamelen, 60 dat zijn 88J, en de overige 40 een mengsel van 86J en 90J.
Elk van de drie isotopen van J heeft zijn eigen atoommassa; dat wil zeggen, hun som van neutronen en protonen. Deze massa's moeten echter worden gemiddeld om een atomaire massa voor J bij de hand te hebben; hier op aarde, want er kunnen andere gebieden van het heelal zijn waar de overvloed van 86J is 56% en niet 60%.
Om de gemiddelde atoommassa van J te berekenen, moet het gewogen gemiddelde van de massa's van zijn isotopen worden verkregen; dat wil zeggen, rekening houdend met het percentage van de overvloed voor elk van hen. Zo hebben we:
Gemiddelde massa (J) = (86 amu) (0,60) + (88 amu) (0,20) + (90 amu) (0,20)
= 87,2 amu
Dat wil zeggen, de gemiddelde atoommassa (ook bekend als het atoomgewicht) van J is 87,2 amu. Ondertussen is de molaire massa 87,2 g / mol. Merk op dat 87.2 dichter bij 88 is dan bij 86, en het is ook ver verwijderd van 90.
Absolute atomaire massa
De absolute atoommassa is de atoommassa uitgedrukt in gram. Uitgaande van het voorbeeld van het hypothetische element J, kunnen we de absolute atomaire massa (die van het gemiddelde) berekenen, wetende dat elke amu equivalent is aan 1,6605 · 10-24 gram:
Absolute atoommassa (J) = 87,2 amu * (1,6605 · 10-24 g / ben)
= 1.447956 10-22 g / atoom J
Dit betekent dat de J-atomen gemiddeld een absolute massa hebben van 1.447956 · 10-22 g.
Relatieve atomaire massa
De relatieve atomaire massa is numeriek identiek aan de gemiddelde atomaire massa voor een bepaald element; In tegenstelling tot de tweede, mist de eerste echter eenheid. Daarom is het dimensieloos. De gemiddelde atoommassa van beryllium is bijvoorbeeld 9,012182 u; terwijl zijn relatieve atomaire massa gewoon 9.012182 is.
Dat is de reden waarom deze concepten soms verkeerd worden geïnterpreteerd als synoniemen, omdat ze erg op elkaar lijken en de verschillen ertussen subtiel zijn. Maar waar hebben deze massa's betrekking op? Ten opzichte van een twaalfde van de massa van de 12C.
Een element met een relatieve atomaire massa van 77 betekent dus dat het een massa heeft die 77 keer groter is dan 1/12 van de 12C.
Degenen die naar de elementen in het periodiek systeem hebben gekeken, zullen zien dat hun massa relatief uitgedrukt is. Ze hebben geen eenheden van amu, en het wordt geïnterpreteerd als: ijzer heeft een atomaire massa van 55.846, wat betekent dat het 55.846 keer meer massa is dan de massa van 1/12 van de 12C, en die ook kan worden uitgedrukt als 55,846 amu of 55,846 g / mol.
Hoe atomaire massa te berekenen
Wiskundig gezien werd een voorbeeld gegeven van hoe het te berekenen met het voorbeeld van element J. In algemene termen moet de gewogen gemiddelde formule worden toegepast, namelijk:
P = Σ (isotoop atomaire massa) (overvloed in decimalen)
Met andere woorden, met de atoommassa's (neutronen + protonen) van elke isotoop (normaal natuurlijk) voor een bepaald element, evenals hun respectieve aardse abundanties (of wat de regio ook beschouwt), kan het gewogen gemiddelde worden berekend..
En waarom niet alleen het rekenkundig gemiddelde? De gemiddelde atoommassa van J is bijvoorbeeld 87,2 amu. Als we deze massa opnieuw maar rekenkundig berekenen, hebben we:
Gemiddelde massa (J) = (88 amu + 86 amu + 90 amu) / 3
= 88 amu
Merk op dat er een belangrijk verschil is tussen 88 en 87,2. Dit komt doordat het rekenkundig gemiddelde ervan uitgaat dat de abundantie van alle isotopen hetzelfde is; Aangezien er drie isotopen van J zijn, zou elk een overvloed van 100/3 (33,33%) moeten hebben. Maar dit is in werkelijkheid niet het geval: er zijn veel meer isotopen dan andere.
Daarom wordt het gewogen gemiddelde berekend, omdat het rekening houdt met hoe overvloedig de ene isotoop is ten opzichte van de andere..
Voorbeelden
Koolstof
Om de gemiddelde atoommassa van koolstof te berekenen, hebben we de natuurlijke isotopen met hun respectievelijke abundanties nodig. In het geval van koolstof zijn dit: 12C (98,89%) en 13C (1,11%). Hun relatieve atomaire massa is respectievelijk 12 en 13, die op hun beurt gelijk zijn aan 12 amu en 13 amu. Oplossen:
Gemiddelde atomaire massa (C) = (12 amu) (0.9889) + (13 amu) (0.0111)
= 12.0111 amu
Daarom is de massa van een koolstofatoom gemiddeld 12,01 amu. Omdat er sporen van zijn 14C, heeft vrijwel geen invloed op dit gemiddelde.
Natrium
Alle aardse natriumatomen bestaan uit de isotoop 2. 3Na, dus zijn overvloed is 100%. Daarom kan in gewone berekeningen worden aangenomen dat de massa eenvoudigweg 23 amu of 23 g / mol is. De exacte massa is echter 22,98976928 amu.
Zuurstof
De drie isotopen van zuurstof met hun respectievelijke hoeveelheden zijn: 16O (99,762%), 17O (0,038%) en 18O (0,2%). We hebben alles om de gemiddelde atomaire massa te berekenen:
Gemiddelde atomaire massa (O) = (16 amu) (0.99762) + (17 amu) (0.00038) + (18 amu) (0.002)
= 16.00438 amu
Hoewel de gerapporteerde exacte massa eigenlijk 15.9994 amu is.
Stikstof
We herhalen dezelfde stappen met zuurstof die we hebben: 14N (99,634%) en vijftienN (0,366%). Dan:
Gemiddelde atomaire massa (N) = (14 amu) (0,99634) + (15 amu) (0,00366)
= 14.00366 amu
Merk op dat de gerapporteerde massa voor stikstof 14.0067 amu is, iets hoger dan degene die we hebben berekend.
Chloor
De isotopen van chloor met hun respectievelijke abundanties zijn: 35Cl (75,77%) en 37Cl (24,23%). Als we de gemiddelde atomaire massa berekenen, hebben we:
Gemiddelde atomaire massa (Cl) = (35 amu) (0,7577) + (37 amu) (0,2423)
= 35,4846 amu
Zeer vergelijkbaar met dat gerapporteerd (35.453 amu).
Dysprosium
En tot slot wordt de gemiddelde massa van een element met veel natuurlijke isotopen berekend: dysprosium. Deze en met hun respectievelijke hoeveelheden zijn: 156Dy (0,06%), 158Dy (0,10%), 160Dy (2,34%), 161Dy (18,91%), 162Dy (25,51%), 163Dy (24,90%) en 164Dy (28,18%).
We gaan verder zoals in de vorige voorbeelden om de atoommassa van dit metaal te berekenen:
Gemiddelde atomaire massa (Dy) = (156 amu) (0,0006%) + (158 amu) (0,0010) + (160 amu) (0,0234) + (161 amu) (0,1891) + (162 amu) (0,2551) + (163 amu) (0.2490) + (164 amu) (0.2818)
= 162.5691 amu
De gerapporteerde massa is 162.500 amu. Merk op dat dit gemiddelde tussen de 162 en 163 ligt, aangezien de isotopen 156Dy, 158Dy en 160Dy zijn er weinig overvloedig; terwijl degenen die overheersen zijn 162Dy, 163Dy en 164Dy.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Wikipedia. (2019). Atoom massa. Hersteld van: en.wikipedia.org
- Christopher Masi. (s.f.). Atomaire massa. Hersteld van: wsc.mass.edu
- Natalie Wolchover. (12 september 2017). Hoe weeg je een atoom? WordsSideKick.com. Hersteld van: livescience.com
- Chemie LibreTexts. (05 juni 2019). Atomaire massa berekenen. Hersteld van: chem.libretexts.orgs
- Edward Wichers en H. Steffen Peiser. (15 december 2017). Atoomgewicht. Encyclopædia Britannica. Hersteld van: britannica.com

Niemand heeft nog op dit artikel gereageerd.