
Chloor (III) oxide-eigenschappen, structuur, gebruik
De chloor (III) oxide is een anorganische verbinding waarvan de chemische formule Cl istweeOF3. Komt overeen met chloorzuuranhydride, HClOtwee. Het is een donkerbruine vaste stof, zeer explosief, zelfs bij temperaturen onder 0ºC, en slecht gekarakteriseerd. Daarom is het een interessant object voor computationele studies..
Chemisch gezien is het een covalent oxide, dus er zijn Cl-O-bindingen en een discreet Cl-molecuultweeOF3 (onderste afbeelding). Zo'n molecuul kan heel goed worden gevormd door HClO te dehydraterentwee, of het onderwerpen aan fotolyse bij lage temperaturen. Het detail is dat het ontleedt en Cl produceerttwee, OFtwee, of andere thermodynamisch stabiele chlooroxiden.
Omdat Cl-O-bindingen slecht polair zijn, is het Cl-molecuultweeOF3 heeft een klein dipoolmoment; daarom lost het niet goed op in water of reageert het niet met andere polaire oplosmiddelen. De instabiliteit is zodanig dat het niet bekend is voor commerciële of potentiële toepassingen (noch zou de toepasbaarheid ervan levensvatbaar zijn als explosief).
De belangrijkste reden voor zijn instabiliteit kan te wijten zijn aan de elektronische kenmerken van de veronderstelde Cl3+ (uitgaande van een puur ionisch karakter). In feite zijn de oxidatietoestanden +1 en +5 het meest stabiel wanneer chloor verbindingen vormt met zuurstof..
Artikel index
- 1 Eigenschappen
- 2 Structuur van chloor (III) oxide
- 2.1 Isomeren
- 3 Nomenclatuur
- 4 toepassingen
- 5 referenties
Eigendommen
Omdat de karakterisering ervan slecht is en slecht gedocumenteerd, valt er niet veel te zeggen over de eigenschappen, behalve de volgende punten:
-Het heeft een molecuulmassa van 118,903.
-Het is een effen donkerbruin; hoewel het gasvormig chloor kan sublimeren, waarbij geelachtig groene dampen vrijkomen.
-Het mist zowel een kookpunt als een smeltpunt, aangezien het bij 0 ° C explodeert (en ook bij koudere temperaturen).
-De oplosbaarheid in water wordt geschat op ongeveer 3,42 g / 100 ml, wat bewijst dat het een covalent molecuul is met een lage polariteit..
-Reageert met water (het weinige dat oplost) om HClO te wordentwee
CltweeOF3 + H.tweeOF <=> 2HClOtwee
Structuur van chloor (III) oxide
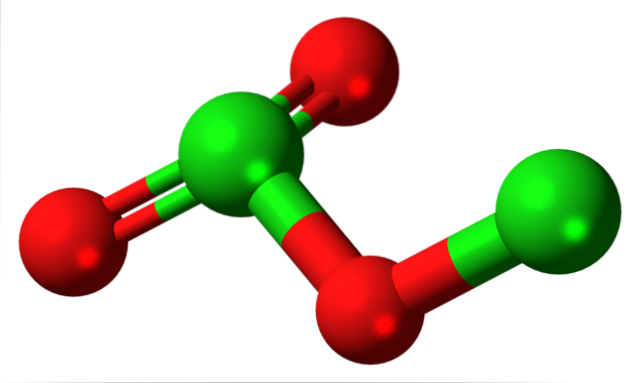
De afbeelding toonde de moleculaire structuur van CltweeOF3 met een model van bollen en staven. Hoewel het op het eerste gezicht misschien niet zo lijkt, zijn de onuitgesproken implicaties van uw links en ruimtelijke ordeningen ingewikkelder dan ze lijken. Deze structuur komt overeen met een van de vele mogelijke isomeren voor deze verbinding..
De rode bollen komen overeen met zuurstofatomen en de groene bollen met chlooratomen. Het chloor aan de linkerkant heeft een trigonale piramidegeometrie, met een paar vrije elektronen; dus kan worden aangenomen dat hun hybridisatie sp3. Een zuurstofatoom fungeert als een brug tussen de twee chloorverbindingen, Cl-O-Cl.
Isomeren
Wat zijn de andere isomeren? In theorie worden er negen berekend, waarvan er vier het meest stabiel zijn (inclusief die op de afbeelding). De andere drie zouden structuren hebben zoals:
-ClClO3. Lijkt sterk op degene die wordt uitgelegd, maar met een Cl-Cl-binding.
-ClOOOCl (1). In dit isomeer zit een brug van drie zuurstofatomen die de twee chlooratomen scheiden (denk aan de hoekgeometrie van HtweeOf om het te visualiseren).
-ClOOOCl (2). Dezelfde zuurstofrijke brug is ook aanwezig in dit isomeer, behalve dat de twee chlooratomen in de ruimte worden verduisterd; tegenover elkaar, terwijl ze in de bovenstaande isomeer ver weg zijn.
Nomenclatuur
De naam, chlooroxide (III), komt overeen met de naam die is toegekend volgens de voorraadnomenclatuur. Hier wordt aangenomen dat chloor een oxidatietoestand heeft van +3; maar het betekent niet dat het Cl kation3+ kan aanwezig zijn. Het is een molecuul, geen netwerk van ionen.
Een andere naam waaronder Cl ook bekend istweeOF3 is dichloortrioxide, volgens de systematische nomenclatuur.
En tot slot, niet zo gebruikelijk (ondanks dat het wordt beheerst door de traditionele nomenclatuur), is er de naam chlooranhydride om naar deze verbinding te verwijzen. Deze naam is te danken aan het feit dat, zoals al uitgelegd, de CltweeOF3 treedt op wanneer HClOtwee condenseert waarbij water vrijkomt.
Toepassingen
Omdat het een chlooroxide is, is het meest directe gebruik dat kan worden bedacht voor CltweeOF3 Het is als een oxidatiemiddel dat in staat is organische onzuiverheden en microben te neutraliseren. Het is echter erg onstabiel en ook explosief, dus het wordt voor dit doel niet eens als nuttig beschouwd..
Er is zeker geen informatie over hoe de Cl zich zou gedragen.tweeOF3 onder enorme druk (als het niet ontploft tijdens het proces). Onder normale omstandigheden blijkt het niets meer te zijn dan een relatief stabiel en differentieerbaar tussenproduct tussen andere stabielere chlooroxiden..
Computationeel is het echter het object van studie geweest om mechanismen van vrije radicalen vast te stellen waarbij verschillende soorten chloor en zuurstof betrokken zijn..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Dichloortrioxide. Hersteld van: en.wikipedia.org
- Dale L. Perry. (2011). Handboek van anorganische verbindingen. (tweede druk). CRC Press Taylor & Francis Group.
- Richard C. Ropp. (2013). Encyclopedie van de alkalische aardeverbindingen. Elsevier.
- Kim K. H., Han Y.K. en Lee Y. S. (1999). Effecten van de basisset op de stabiliteit van de Cl2O3-isomeren met behulp van B3P86- en B3LYP-methoden van dichtheidsfunctionaaltheorie. Journal of Molecular Structure THEOCHEM 460 (1-3): 19-25.



Niemand heeft nog op dit artikel gereageerd.