
SIM medium foundation, voorbereiding en gebruik
De halve simkaart is een halfvaste en differentiële agar, speciaal ontworpen om bepaalde bacteriën te helpen identificeren, voornamelijk van de Enterobacteriaceae-familie. Het is samengesteld uit tripteïne, pepton, ijzersulfaat, ammoniumsulfaat, natriumthiosulfaat en agar..
Met dit medium kunnen drie belangrijke tests worden uitgevoerd: de productie van waterstofsulfide (H.tweeS), indoolvorming en beweeglijkheid, vandaar de afkorting SIM. Vanwege zijn grote bruikbaarheid mag het niet ontbreken in een bacteriologisch laboratorium.

In tegenstelling tot andere media moet het halfvast zijn om het bewegingsvermogen van sommige bacteriën te kunnen detecteren. In die zin werkt deze test heel goed voor Enterobacteriaceae, maar niet voor niet-fermenterende Gram-negatieve staafjes, waar het de voorkeur heeft om andere methoden te gebruiken, zoals hangende druppel..
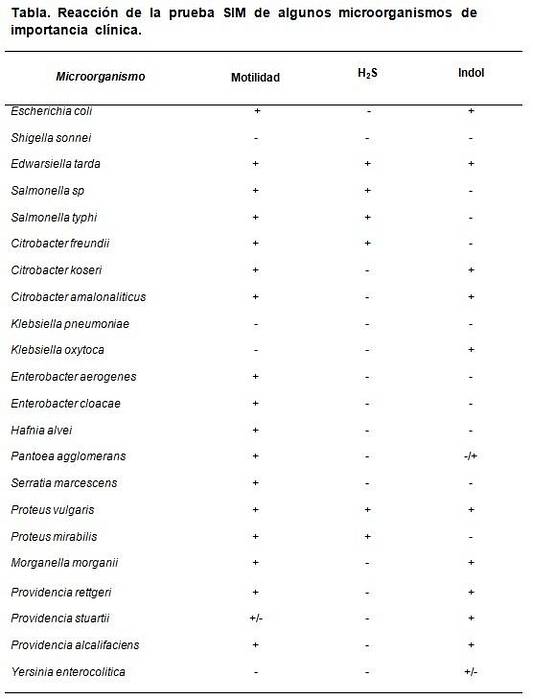
Het SIM-medium maakt het mogelijk om bepaalde specifieke eigenschappen te onderscheiden die sommige bacteriën kenmerken in relatie tot andere. Bijvoorbeeld Escherichia coli onderscheidt zich door H te zijntweeS (-), Indole (+) en beweeglijkheid (+), while Proteus mirabilis het is HtweeS (+), indool (-), beweeglijkheid (+).
Artikel index
- 1 Grondgedachte
- 1.1 Stroombron
- 1.2 Productie van waterstofsulfide
- 1.3 Vorming van indool
- 1.4 Motiliteit
- 2 Voorbereiding
- 2.1 Middelgrote simkaart
- 2.2 Kovac's reagens
- 2.3 Erlich's reagens
- 3 toepassingen
- 3.1 Zaaien
- 4 Kwaliteitscontrole
- 5 Beperkingen
- 6 referenties
Basis
Het is een kweekmedium dat als differentieel wordt beschouwd, omdat het gebruik ervan onderscheid maakt tussen micro-organismen die waterstofsulfide kunnen produceren en micro-organismen die dat niet doen; Het benadrukt ook degenen die indool vormen uit tryptofaan en degenen die het niet vormen, en tenslotte onderscheidt het de beweeglijke bacteriën van de immobiele bacteriën..
Krachtbron
Zoals elk kweekmedium bevat het elementen die de nodige voedingsstoffen leveren, zodat niet-veeleisende micro-organismen zich kunnen ontwikkelen. Deze elementen worden vertegenwoordigd door peptonen en triptein.
De ontwikkeling van het micro-organisme in het medium is essentieel om de aan- of afwezigheid van de kenmerken die dit medium evalueert te kunnen waarnemen..
Productie van waterstofsulfide
De letter S van het acroniem SIM verwijst naar de productie van waterstofsulfide (H.tweeS). Bacteriën die waterstofsulfide kunnen vormen, zullen de zwavel uit natriumthiosulfaat opnemen.
Zodra de HtweeS -kleurloos gas-, dit reageert met het in het medium aanwezige ijzerzout en vormt ferrosulfide, duidelijk zichtbaar (zwart neerslag). Bacteriën die geen H vormentweeJa, laat het midden van de originele kleur (beige) staan.
De aanwezigheid van het zwarte neerslag kan de interpretatie van beweeglijkheid belemmeren. Het is echter bekend dat de meeste H-producerende EnterobacteriaceaetweeS zijn positieve beweeglijkheid, zoals Salmonella, Proteus en Citrobacter. Bovendien suggereert het zwarte neerslag dat bijna het hele medium bedekt, positieve beweeglijkheid.
Indool-formatie
De tweede letter van het acroniem SIM is "I", wat staat voor de vorming van indool.
In die zin vervult tripteïne, naast een bron van voedingsstoffen, nog een andere fundamentele functie. Dit pepton is rijk aan het aminozuur tryptofaan en kan daarom de bacteriën laten zien die tryptofanase produceren.
Dit enzym is verantwoordelijk voor de splitsing van het aminozuur tryptofaan, met als gevolg de vorming van indool (kleurloze stof), pyrodruivenzuur en ammonium..
Om deze reactie te demonstreren, is het daarom nodig om een onthullende stof toe te voegen (Ehrlich's reagens of Kovac's reagens). Beide reageren met indool en vormen een rood-fuchsia ringvormige substantie op het oppervlak van de agar. Als de fuchsia-ring verschijnt, wordt de indooltest als positief geïnterpreteerd.
Bacteriën die dit enzym niet bezitten, zullen de ring niet vormen en het wordt geïnterpreteerd als een negatieve indooltest.
Het is belangrijk op te merken dat de indooltest de laatste moet zijn die moet worden geïnterpreteerd, aangezien zodra het reagens is toegevoegd, het medium troebel wordt, waardoor het moeilijk wordt om de beweeglijkheid te visualiseren..
Beweeglijkheid
Ten slotte betekent de letter "M" van het woord SIM beweeglijkheid. Om de beweeglijkheid te kunnen beoordelen, is dit medium strategisch halfvast, aangezien deze eigenschap essentieel is om te kunnen observeren of er al dan niet bacteriële beweging is. Bacteriën met flagella zijn degenen die deze positieve test geven.
Een positieve test zal duidelijk zijn wanneer troebelheid wordt waargenomen, zowel in het initiële inoculum als eromheen. Terwijl niet-beweeglijke bacteriën zich alleen ontwikkelen op het pad van het eerste inoculum.
Voorbereiding
Middelgrote simkaart
Weeg 30 g van het gedehydrateerde medium af en los op in een liter gedestilleerd water. Het mengsel wordt 5 minuten met rust gelaten en vervolgens tot koken verhit, onder regelmatig roeren tot het volledig is opgelost..
Verdeel het mengsel in reageerbuizen met katoenen doppen en autoclaaf gedurende 15 minuten bij 121 ° C. Haal het buizenrek uit de autoclaaf en laat in verticale positie stollen, zodat het medium de vorm van een blok krijgt.
Om het te bewaren, wordt het tot gebruik in de koelkast bewaard. Het bereide medium moet een uiteindelijke pH hebben van 7,3 ± 0,2.
Op het moment van inoculatie moet het medium op kamertemperatuur zijn. De middelste kleur is beige.
Kovac's reagens
Meet 150 ml amyl-, isoamyl- of butylalcohol af. (Gebruik een van de drie genoemde).
Los 10 g p-dimethylaminobenzaldehyde op. Voeg vervolgens langzaam 50 ml geconcentreerd zoutzuur toe.
Het gebruiksklare reagens is kleurloos of lichtgeel. Het moet in een amberkleurige fles worden bewaard en in de koelkast worden bewaard. Niet gebruiken als het een donkerbruine kleur krijgt; dat aangeeft dat het beschadigd is. Dit reagens heeft de voorkeur als het gaat om Enterobacteriaceae.
Erlich's reagens
Weeg 2 g p-dimethylaminobenzaldehyde af en los op in 190 ml absolute ethylalcohol en meng langzaam met 40 ml geconcentreerd zoutzuur. Bewaar het reagens van Kovac op dezelfde manier. Het reagens van Ehrlich wordt meer gebruikt voor niet-fermenterende en anaërobe bacteriën.
Toepassingen
SIM-medium wordt veel gebruikt in bacteriologische laboratoria. Het heeft het voordeel dat drie essentiële kenmerken bij de identificatie van Enterobacteriaceae in dezelfde buis kunnen worden waargenomen..
Gezaaid
De juiste manier om dit medium te zaaien is met behulp van de naald, waarmee een deel van de te bestuderen zuivere kolonie wordt genomen en verticaal in het midden van het medium wordt gestoken. Er moet een enkele uitval worden uitgevoerd. De punctie mag de onderkant van de buis niet bereiken, het juiste is om slechts tweederde van de diepte te bedekken.
Het wordt niet aanbevolen om het inoculum te herhalen, aangezien dit kan leiden tot verkeerde interpretaties van positieve beweeglijkheid. Het geïnoculeerde medium wordt aëroob gedurende 24 uur bij 37 ° C geïncubeerd..
Na de tijd wordt gekeken of er al dan niet H werd geproduceerdtweeS en beweeglijkheid wordt gelezen. Ten slotte wordt de indool onthuld, voeg 3 tot 4 druppels van het Ehrlich- of Kovac-reagens toe, meng voorzichtig en interpreteer.
QA
Ter controle van de steriliteit worden één of twee buisjes zonder inoculatie gedurende 24 uur in een oven bij 37 ° C geïncubeerd. Verwacht wordt dat er na deze tijd geen groei of kleurverandering zal zijn.
Als kwaliteitscontrole kunnen gecertificeerde bekende stammen worden gebruikt, zoals: Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048, Klebsiella pneumoniae ATCC 13883, Salmonella typhimurium ATCC 14028, Shigella sonnei ATCC 29930, Proteus vulgaris ATCC 13315.
De verwachte resultaten zijn: Escherichia coli H.tweeS negatief, indool en positieve beweeglijkheid, Enterobacter aerogenes alleen positieve beweeglijkheid, Salmonella typhimurium H.tweeS en positieve beweeglijkheid, met negatieve indool. Proteus vulgaris allemaal positief, terwijl Klebsiella pneumoniae Y Shigella sonnei allemaal negatief.
Beperkingen
-Sommige soorten Morganella morganii, Naast andere soorten kunnen ze in dit medium een bruinachtig pigment produceren door de productie van melanine, dit moet niet worden verward met het neerslag van ferrosulfide. Bij onervaren professionals kan deze situatie vals-positieven genereren bij de interpretatie van de H-test.tweeS.
-Strikte aërobe bacteriën groeien alleen op het oppervlak van de buis, waardoor het moeilijk is om de beweeglijkheid te interpreteren.
Referenties
- BD Laboratoria. BBL SIM-medium. 2008 Beschikbaar op: bd.com
- Neogen Laboratories. Sim-medium. Verkrijgbaar bij: foodsafety
- Difco Francisco Soria Melguizo. Sim-medium. 2009 Beschikbaar op: http://f-soria.es
- Brizuela-Lab Laboratorium. Middelgrote simkaart. Beschikbaar op: .brizuela-lab.com
- Britannia Laboratories. Middelgrote simkaart. 2015 Beschikbaar op: studyres.es/doc
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. 5e druk. Redactioneel Panamericana S.A. Argentinië.



Niemand heeft nog op dit artikel gereageerd.