
Meniscus (chemie) waaruit het bestaat en typen
De meniscus is de kromming van het oppervlak van een vloeistof. Het is ook het vrije oppervlak van een vloeistof aan het vloeistof-luchtgrensvlak. Vloeistoffen worden gekenmerkt doordat ze een vast volume hebben en slecht samendrukbaar zijn.
De vorm van vloeistoffen varieert echter door de vorm aan te nemen van de container waarin ze zich bevinden. Deze eigenschap is te wijten aan de willekeurige beweging van de moleculen waaruit ze bestaan..

Vloeistoffen hebben het vermogen om te stromen, een hoge dichtheid te hebben en snel te diffunderen in andere vloeistoffen waarmee ze mengbaar zijn. Ze bezetten het laagste gedeelte van de container door de zwaartekracht, waardoor er aan de bovenkant een niet helemaal vlak vrij oppervlak overblijft. In sommige gevallen kunnen ze speciale vormen aannemen, zoals druppels, bellen en bellen..
De eigenschappen van vloeistoffen zoals smeltpunt, dampdruk, viscositeit en verdampingswarmte zijn afhankelijk van de intensiteit van de intermoleculaire krachten die de vloeistoffen cohesie geven..
Vloeistoffen hebben echter ook een wisselwerking met de houder door adhesiekrachten. De meniscus ontstaat dan uit deze fysische verschijnselen: het verschil tussen de cohesiekrachten tussen de deeltjes van de vloeistof en die van adhesie waardoor ze de wanden nat kunnen maken..
Artikel index
- 1 Wat is de meniscus?
- 1.1 Cohesiekrachten
- 1.2 Hechtingskrachten
- 2 soorten menisci
- 2.1 concaaf
- 2.2 Convex
- 3 Oppervlaktespanning
- 4 Capillariteit
- 5 referenties
Wat is de meniscus?
Zoals zojuist uitgelegd, is de meniscus het resultaat van verschillende fysische verschijnselen, waaronder ook de oppervlaktespanning van de vloeistof kan worden genoemd..
Samenhang krachten
Cohesiekrachten is de fysieke term die de intermoleculaire interacties binnen de vloeistof verklaart. In het geval van water zijn de cohesiekrachten te wijten aan de dipool-dipool-interactie en waterstofbruggen.
Het watermolecuul is bipolair van aard. Dit komt door het feit dat de zuurstof in het molecuul elektronegatief is omdat het een grotere aviditeit heeft voor elektronen dan waterstofatomen, wat bepaalt dat de zuurstof een negatieve lading heeft en de waterstofatomen positief geladen zijn..
Er is een elektrostatische aantrekkingskracht tussen de negatieve lading van een watermolecuul, gelegen op zuurstof, en de positieve lading van een ander watermolecuul, gelegen op waterstofatomen..
Deze interactie is wat bekend staat als de dipool-dipool interactie of kracht, die bijdraagt aan de cohesie van de vloeistof..
Hechtingskrachten
Aan de andere kant kunnen watermoleculen een interactie aangaan met glazen wanden, door de waterstofatomen van de watermoleculen die sterk binden aan de zuurstofatomen op het glasoppervlak gedeeltelijk op te laden..
Dit vormt de adhesiekracht tussen de vloeistof en de stijve wand; informeel wordt gezegd dat de vloeistof de muur nat maakt.
Wanneer een siliconenoplossing op het glasoppervlak wordt geplaatst, doordrenkt het water het glas niet volledig, maar vormen zich druppeltjes op het glas die gemakkelijk kunnen worden verwijderd. Aldus wordt aangegeven dat met deze behandeling de adhesiekracht tussen water en glas wordt verminderd..
Een vergelijkbaar geval doet zich voor wanneer de handen vettig zijn en wanneer ze in water worden gewassen, zijn er zeer gedefinieerde druppels op de huid te zien in plaats van op een vochtige huid.
Soorten menisci
Er zijn twee soorten menisci: de concave en de convexe. In de afbeelding is de concaaf A en de convexe B. De stippellijnen geven het juiste niveau aan bij het lezen van een volumemeting.
Concaaf
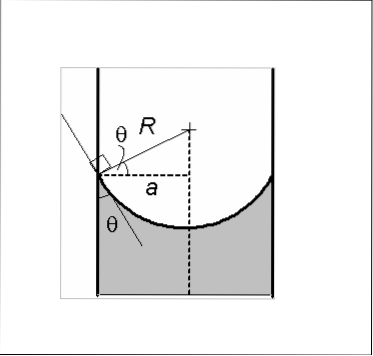
De concave meniscus kenmerkt zich doordat de contacthoek θ gevormd door de glaswand met een lijn die raakt aan de meniscus en die in de vloeistof wordt gebracht, een waarde heeft kleiner dan 90º. Als een hoeveelheid vloeistof op het glas wordt geplaatst, heeft deze de neiging zich over het glasoppervlak te verspreiden..
De aanwezigheid van een concave meniscus toont aan dat de cohesiekrachten in de vloeistof kleiner zijn dan de adhesiekracht van de vloeistof-glaswand.
Daarom baadt of bevochtigt de vloeistof de glaswand, waarbij een hoeveelheid vloeistof wordt vastgehouden en de meniscus een concave vorm krijgt. Water is een voorbeeld van een vloeistof die concave menisci vormt.
Convex
Bij de bolle meniscus heeft de contacthoek θ een waarde groter dan 90º. Kwik is een voorbeeld van een vloeistof die convexe menisci vormt. Wanneer een druppel kwik op een glazen oppervlak wordt geplaatst, heeft de contacthoek θ een waarde van 140º.
De waarneming van een bolle meniscus geeft aan dat de cohesiekrachten van de vloeistof groter zijn dan de adhesiekracht tussen de vloeistof en de glaswand. Er wordt gezegd dat de vloeistof het glas niet nat maakt.
De oppervlaktekrachten cohesie (vloeistof-vloeistof) en adhesie (vloeistof-vast) zijn verantwoordelijk voor vele verschijnselen van biologisch belang; dat is het geval bij oppervlaktespanning en capillaire werking.
Oppervlaktespanning
Oppervlaktespanning is een netto aantrekkingskracht die wordt uitgeoefend op de moleculen van de vloeistof die zich op het oppervlak bevinden en die de neiging heeft ze in de vloeistof te introduceren..
Daarom heeft de oppervlaktespanning de neiging om de vloeistof samen te laten smelten en ze meer concave menisci te geven; Of anders gezegd: deze kracht heeft de neiging om het vloeistofoppervlak van de glaswand te verwijderen.
De oppervlaktespanning neemt af naarmate de temperatuur stijgt, bijvoorbeeld: de oppervlaktespanning van water is gelijk aan 0,076 N / m bij 0 ºC en 0,059 N / m bij 100 ºC.
Ondertussen is de oppervlaktespanning van kwik bij 20 ºC 0,465 N / m. Dit zou verklaren waarom kwik convexe menisci vormt.
Capillariteit
Als de contacthoek θ kleiner is dan 90º, en de vloeistof maakt de glaswand nat, kan de vloeistof in de glazen capillairen stijgen tot een evenwichtstoestand.
Het gewicht van de vloeistofkolom wordt gecompenseerd door de verticale component van de cohesiekracht als gevolg van oppervlaktespanning. De adhesiekracht grijpt niet in omdat ze loodrecht op het oppervlak van de buis staan.
Deze wet legt niet uit hoe water van de wortels naar de bladeren kan stijgen door de vaten van het xyleem..
Eigenlijk zijn er nog andere factoren die hierbij een rol spelen, bijvoorbeeld: naarmate het water verdampt in de bladeren, kunnen de watermoleculen in het bovenste deel van de haarvaten worden opgezogen..
Hierdoor kunnen andere moleculen van de onderkant van de haarvaten opstijgen om de plaats van de verdampte watermoleculen in te nemen..
Referenties
- Ganong, W. F. (2002). Medische fysiologie. 2002. 19e editie. Modern Manual Redactioneel.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Helmenstine, Anne Marie, Ph.D. (4 augustus 2018). Hoe een meniscus in de chemie te lezen. Hersteld van: thoughtco.com
- Wikipedia. (2018). Meniscus (vloeibaar). Hersteld van: en.wikipedia.org
- Friedl S. (2018). Wat is een meniscus? Studie. Hersteld van: study.com
- Oppervlaktespanning. Hersteld van: chem.purdue.edu


Niemand heeft nog op dit artikel gereageerd.