
Myofilamenttypes, structuur en organisatie
De myofilamenten zijn de contractiele eiwitten van myofibrillen, de structurele eenheden van spiercellen, langwerpige cellen die spiervezels worden genoemd.
Spiervezels en hun componenten hebben een bepaalde naam. Het membraan, het cytoplasma, de mitochondriën en het endoplasmatisch reticulum staan bijvoorbeeld bekend als respectievelijk sarcolemma, sarcoplasma, sarcosomen en sarcoplasmatisch reticulum..
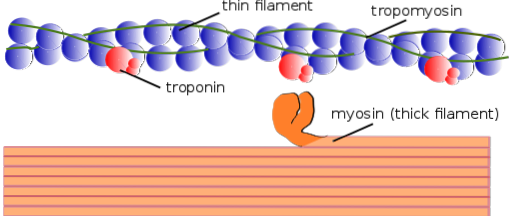
Op dezelfde manier worden de contractiele elementen binnenin gezamenlijk myofibrillen genoemd; en de contractiele eiwitten waaruit myofibrillen bestaan, worden myofilamenten genoemd.
Er zijn twee soorten myofilamenten: dun en dik. De dunne filamenten bestaan voornamelijk uit drie eiwitten: F-actine, tropomyosine en troponine. De dikke filamenten bestaan uitsluitend uit een ander eiwit dat bekend staat als myosine II.
Naast deze zijn er andere eiwitten die zijn geassocieerd met zowel dikke als dunne filamenten, maar deze hebben geen contractiele functies, maar eerder structurele, waaronder, om er maar een paar te noemen, titine en nebuline..
Artikel index
- 1 Soorten spiervezels
- 2 Structuur
- 2.1 Dunne myofilamenten
- 2.2 Dikke myofilamenten
- 3 Organisatie
- 3.1 Hoe zijn myofilamenten georganiseerd binnen sarcomeren?
- 4 Mechanisme van contractie
- 5 referenties
Soorten spiervezels
De specifieke opstelling van de myofilamenten waaruit de myofibrillen bestaan, geeft aanleiding tot twee soorten spiervezels: dwarsgestreepte spiervezels en gladde spiervezels.
Gegroefde spiervezels vertonen, wanneer ze onder een lichtmicroscoop worden onderzocht, een patroon van strepen of transversale banden die zich over hun gehele oppervlak herhalen en die de naam geven aan de spier die ze bevat, van dwarsgestreepte spieren. Er zijn twee soorten dwarsgestreepte spiervezels, skeletaal en hart.
Spiervezels die dit patroon van dwarsbanden niet vertonen, worden gladde vezels genoemd. Het zijn degenen die de spieren van de vaatwanden en de ingewanden vormen.
Structuur
Dunne myofilamenten
Deze myofilamenten zijn samengesteld uit F-actine en twee geassocieerde eiwitten: tropomyosine en troponine, die regulerende functies hebben..
F-actine, of filamenteus actine, is een polymeer van een ander kleiner globulair eiwit, G-actine of globulair actine genaamd, met een molecuulgewicht van ongeveer 42 kDa. Het heeft een bindingsplaats voor myosine en het is gerangschikt door twee kettingen te vormen die zijn gerangschikt als een dubbele helix die is samengesteld uit ongeveer 13 monomeer per omwenteling..
F-actine-filamenten worden gekenmerkt door twee polen: de ene positief, gericht naar de Z-schijf en de andere negatief, gericht naar het midden van de sarcomeer.
Tropomyosine bestaat ook uit een dubbele-helix-polypeptide dubbele keten. Het is een eiwit van 64 kDa dat filamenten vormt die zich bevinden in de groeven die zijn achtergelaten door de dubbele helixketens van de dunne F-actine-filamenten, alsof ze de lege ruimtes in de helix "opvullen"..
In rust bedekt of "bedekt" tropomyosine de bindingsplaatsen van actine voor myosine, waardoor de interactie van beide eiwitten wordt voorkomen, wat spiercontractie veroorzaakt. Rond elk dun filament en ongeveer 25-30 m vanaf het begin van elk tropomyosine bevindt zich een ander eiwit dat troponine wordt genoemd.
Troponine (Tn) is een eiwitcomplex dat bestaat uit drie bolvormige polypeptidesubeenheden genaamd troponine T, C en I.Elke tropomyosinemolecuul heeft een geassocieerd troponinecomplex dat het reguleert, en samen zijn ze verantwoordelijk voor de regulatie van het begin en het beëindigen van spiercontractie..
Dikke myofilamenten
De dikke filamenten zijn polymeren van myosine II, met een gewicht van 510 kDa en bestaande uit twee zware ketens van elk 222 kDa en vier lichte ketens. Lichte ketens zijn van twee typen: 18 kDa essentiële lichte ketens en 22 kDa gereguleerde lichte ketens..
Elke zware ketting van myosin II heeft de vorm van een staaf met aan het uiteinde een kleine bolvormige kop die bijna 90 ° uitsteekt en twee bindingsplaatsen heeft, een voor actine en een voor ATP. Daarom behoren deze eiwitten tot de ATPase-familie..
Een dik filament bestaat uit meer dan 200 myosine II-moleculen. De bolvormige kop van elk van deze moleculen fungeert als een "peddel" tijdens contractie, waarbij het actine waaraan het is vastgemaakt wordt geduwd zodat het naar het midden van het sarcomeer glijdt..
Organisatie
In een skeletale dwarsgestreepte spiervezel bezetten de myofibrillen het grootste deel van het sarcoplasma en zijn ze gerangschikt in longitudinale en geordende assemblages door de cel.
In een lengtedoorsnede gezien met een optische microscoop, worden lichte banden waargenomen, banden I genoemd, en donkere banden, banden A genoemd. Deze banden komen overeen met de geordende rangschikking van de myofibrillen, en dus van de myofilamenten waaruit ze bestaan..
In het midden van Band I is er een donkere en dunne lijn genaamd Line of Z Disk. Het midden van elke Band A heeft een lichter gebied dat bekend staat als Band H, dat centraal wordt gedeeld door een donkere lijn genaamd Line M.
Afbakening tussen twee Z-lijnen, wordt een structuur genaamd sarcomeer beschreven, de functionele eenheid van de skeletspier. Een sarcomeer is samengesteld uit contractiele myofilamenten die ordelijk zijn gerangschikt in banden A, H en een hemiband I aan elk uiteinde..
De I-banden bevatten alleen dunne filamenten, de A-band bevat dikke filamenten die aan hun twee uiteinden zijn verweven met fijne filamenten en de H-band bevat alleen dikke filamenten.
Hoe zijn myofilamenten georganiseerd binnen sarcomeren?
Zowel dikke als dunne myofilamenten zijn te zien bij het onderzoeken van een skeletspiermonster onder een elektronenmicroscoop. Deze zouden "in elkaar grijpen" of "verstrengelen" met elkaar in een opeenvolgende, geordende en parallelle opstelling..
De dunne filamenten zijn afkomstig van de Z-schijven en strekken zich aan weerszijden uit in de tegenovergestelde richting en naar het midden van elk aangrenzend sarcomeer. Van de Z-schijven aan elk uiteinde van het sarcomeer, in ontspannen spier, reist actine naar het begin van de H-band aan elke kant.
In de spiervezels van ontspannen skeletspieren bezetten de dikke myofilamenten dus het centrale gebied dat de donkere banden of A-banden vormt; en de dunne filamenten strekken zich uit aan beide zijden van het sarcomeer zonder het midden van het sarcomeer te bereiken.
In een dwarsdoorsnede in het gebied waar de dikke en dunne filamenten elkaar overlappen, kan een hexagonaal patroon worden waargenomen dat het dikke filament in het midden en zes dunne filamenten eromheen omvat, en die zich in elk van de randen van de zeshoek bevinden..
Deze organisatie van myofilamenten in het sarcomeer wordt behouden door de functie van een reeks eiwitten die geassocieerd zijn met myofilamenten en die structurele functies hebben, waaronder titine, alfa-actine, nebuline, myomesine en proteïne C kunnen worden benadrukt..
Mechanisme van contractie
Wanneer acetylcholine (een neurotransmitter) wordt vrijgegeven in de neuromusculaire plaat door stimulatie van een motorneuron, wordt de spiervezel geëxciteerd en worden de spanningsafhankelijke calciumkanalen van het sarcoplasmatisch reticulum geopend.
Calcium bindt aan troponine C, en dit veroorzaakt een conformationele verandering in tropomyosine, die de actieve plaatsen van actine blootstelt, waardoor contractie wordt geïnitieerd. Wanneer het calciumgehalte daalt, keert tropomyosine terug naar zijn oorspronkelijke positie en houdt de contractie op..
Door de actine-bindingsplaatsen aan myosine bloot te stellen, kunnen beide eiwitten binden en kan het myosine het actine naar het midden van het sarcomeer duwen en over het myosine glijden..
Tijdens spiercontractie naderen de Z-lijnen van elke sarcomeer naar het midden, nadert de M-lijn, vergroot de interdigitatie tussen actine en myosine en verkleint de grootte van de I- en H-banden. De mate van verkorting hangt af van de som van de verkorting van elk van de sarcomeren van de samengetrokken spier.
Referenties
- Berne, R., & Levy, M. (1990). Fysiologie. Mosby; Internationale editie.
- Fox, S. I. (2006). Menselijke fysiologie (9e ed.). New York, VS: McGraw-Hill Press.
- Gartner, L., en Hiatt, J. (2002). Histologie Atlas-tekst (2e ed.). México D.F.: McGraw-Hill Interamericana Editores.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harper's geïllustreerde biochemie (28e ed.). McGraw-Hill Medical.
- Rawn, J. D. (1998). Biochemie. Burlington, Massachusetts: uitgeverij Neil Patterson.
- Ross, M., en Pawlina, W. (2006). Histologie. Een tekst en atlas met gecorreleerde cel- en moleculaire biologie (5e ed.). Lippincott Williams & Wilkins.
- West, J. (1998). Fysiologische basis van de medische praktijk (12e ed.). México D.F.: Redactie Médica Panamericana.
Niemand heeft nog op dit artikel gereageerd.