
Bohr atomaire modelkenmerken, postulaten, beperkingen

De Bohr atomair model is de opvatting van de Deense natuurkundige Niels Bohr (1885-1962) van de structuur van het atoom, gepubliceerd in 1913. In het Bohr-atoom bezetten de elektronen rond de kern alleen bepaalde toegestane banen, dankzij een beperking genaamd kwantisering.
Voor Bohr was het beeld van het atoom als een miniatuurzonnestelsel, met elektronen die rond de kern cirkelden, niet helemaal in overeenstemming met het feit dat elektrische ladingen, wanneer ze worden versneld, energie uitstralen..
Zo'n atoom zou niet stabiel zijn, omdat het vroeg of laat zou instorten omdat de elektronen naar de kern zouden spiraliseren. En tegen die tijd waren de karakteristieke lichtpatronen die waterstof en andere gassen bij verhitting uitstoten al 50 jaar bekend..
Het patroon of spectrum bestaat uit een reeks heldere lijnen van bepaalde zeer specifieke golflengten. En het waterstofatoom stort niet in door licht uit te zenden.
Om uit te leggen waarom het atoom stabiel is ondanks het feit dat het elektromagnetische energie kan uitstralen, stelde Bohr voor dat impulsmoment alleen bepaalde waarden kan aannemen, en dus ook energie. Dit wordt bedoeld met kwantisering.
Aanvaardend dat de energie werd gekwantiseerd, zou het elektron de nodige stabiliteit hebben om niet naar de kern te rennen die het atoom vernietigt..
En het atoom straalt alleen lichtenergie uit als het elektron van de ene baan naar de andere overgaat, altijd in discrete hoeveelheden. Op deze manier wordt de aanwezigheid van emissiepatronen in waterstof verklaard..
Bohr stelde zo een visie op het atoom samen door bekende concepten uit de klassieke mechanica te integreren met nieuw ontdekte concepten, zoals de constante van Planck, het foton, het elektron, de atoomkern (Rutherford was Bohr's mentor geweest) en de bovengenoemde spectra van kwestie..
Artikel index
- 1 Hoofdkenmerken van het Bohr-model
- 1.1 Berekening van de straal van de baan van het elektron
- 2 Postulaten van het atomaire model van Bohr
- 2.1 Elektronen beschrijven cirkelvormige paden
- 2.2 Het impulsmoment wordt gekwantiseerd
- 2.3 Elektronen zenden of absorberen fotonen wanneer ze van de ene energietoestand naar de andere gaan
- 3 Beperkingen
- 4 artikelen van belang
- 5 referenties
Belangrijkste kenmerken van het Bohr-model
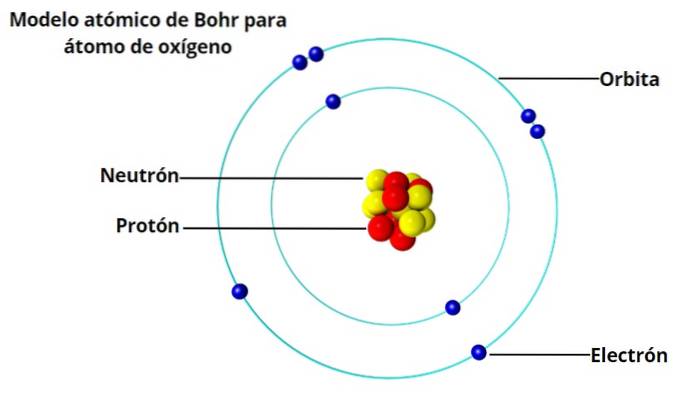
Bohr's atomaire model gaat ervan uit dat het elektron in een cirkelvormige baan rond de kern beweegt door de werking van de elektrostatische aantrekkingskracht van Coulomb en stelt voor dat het impulsmoment van het elektron wordt gekwantiseerd.
Laten we eens kijken hoe we beide concepten in wiskundige vorm kunnen integreren:
Laat L de grootte van het impulsmoment zijn, m de massa van het elektron, v de snelheid van het elektron en r de straal van de baan. Om L te berekenen hebben we:
L = m⋅r⋅v
Bohr stelde voor dat L gelijk was aan gehele veelvouden van de constante h / 2π, waarbij h de Planck is constant, kort geleden geïntroduceerd door de natuurkundige Max Planck (1858-1947) bij het oplossen van het probleem van de energie die wordt uitgezonden door een zwart lichaam, een theoretisch object dat al het invallende licht absorbeert.
De waarde is h = 6,626 × 10-34 J ・ s, terwijl een h / 2π wordt aangeduid als ħ, wat wordt gelezen "H bar".
Daarom blijft het impulsmoment L:
m⋅r⋅v = nħ, met n = 1,2, 3 ...
En uit deze toestand worden de stralen van de banen die voor het elektron zijn toegestaan, afgeleid, zoals we hieronder zullen zien.
Berekening van de straal van de baan van het elektron
In wat volgt gaan we uit van de eenvoudigste van de atomen: waterstof, dat bestaat uit een enkel proton en een elektron, beide met een lading van grootte e.
De centripetale kracht die het elektron in zijn cirkelvormige baan houdt, wordt geleverd door elektrostatische aantrekkingskracht, waarvan de grootte F is:
F = ketwee/ rtwee
Waar k de elektrostatische constante is van de wet van Coulomb en r de afstand tussen elektronen en protonen. Wetende dat in een cirkelvormige beweging de middelpuntzoekende versnelling bijc wordt gegeven door de verhouding tussen het kwadraat van de snelheid en de afstand r:
naarc = vtwee / r
Volgens de tweede wet van Newton is de nettokracht het product van de massa m en de versnelling:
mvtwee/ r = ketwee/ rtwee
Als we de straal r vereenvoudigen, krijgen we:
m⋅vtweer = ketwee
Door deze uitdrukking te combineren met die van impulsmoment hebben we een stelsel vergelijkingen, gegeven door:
1) mvtweer = ketwee
2) r = n ħ/ mv
Het idee is om het systeem op te lossen en r te bepalen, de straal van de toegestane baan. Een kleine elementaire algebra leidt tot het antwoord:
r = (nħtwee / k⋅m⋅etwee
Met n = 1, 2, 3, 4, 5 ...
Voor n = 1 hebben we de kleinste van de stralen, genaamd Bohr straal naarof met een waarde van 0,529 × 10−10 m. De stralen van de andere banen worden uitgedrukt in termen van naarof.
Op deze manier introduceert Bohr het hoofdkwantumgetal n, opmerkend dat de toegestane stralen een functie zijn van de constante van Planck, de elektrostatische constante en de massa en lading van het elektron.
Bohr's atomaire model postuleert

Bohr combineert vakkundig de Newtoniaanse mechanica met nieuwe ontdekkingen die voortdurend plaatsvonden in de tweede helft van de negentiende en vroege twintigste eeuw. Onder hen het revolutionaire concept van het "kwantum", waarvan Planck zelf beweerde niet erg overtuigd te zijn.
Door zijn theorie was Bohr in staat de reeks in het waterstofspectrum op bevredigende wijze te verklaren en energie-emissies in het ultraviolette en infrarode bereik te voorspellen, die nog niet waren waargenomen..
We kunnen zijn postulaten als volgt samenvatten:
Elektronen beschrijven cirkelvormige paden
Het elektron draait rond de kern in een stabiele cirkelvormige baan, met een uniforme cirkelvormige beweging. De beweging is te wijten aan de elektrostatische aantrekkingskracht die de kern erop uitoefent.
Het impulsmoment wordt gekwantiseerd
Het impulsmoment van het elektron wordt gekwantiseerd volgens de uitdrukking:
L = mvr = nħ
Waarbij n een geheel getal is: n = 1, 2, 3, 4 ..., wat ertoe leidt dat het elektron alleen in bepaalde gedefinieerde banen kan zijn, waarvan de stralen zijn:
r = (n ħtwee / k m etwee
Elektronen zenden of absorberen fotonen wanneer ze van de ene energietoestand naar de andere gaan
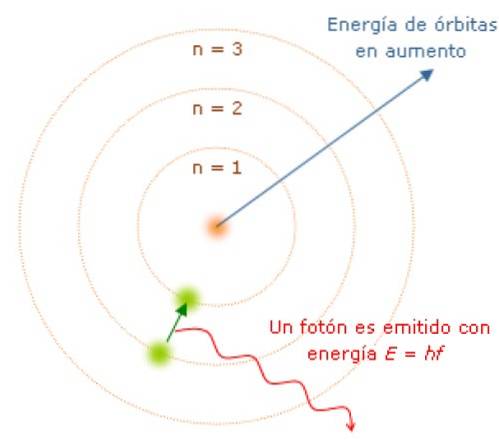
Omdat het impulsmoment wordt gekwantiseerd, geldt dat ook voor de energie E. Er kan worden aangetoond dat E wordt gegeven door:


Het elektron volt, of eV, is een andere eenheid voor energie die veel wordt gebruikt in de atoomfysica. Het minteken in de energie zorgt voor de stabiliteit van de baan, wat aangeeft dat er werk moet worden verzet om het elektron van deze positie te scheiden..
Terwijl het elektron zich in zijn baan bevindt, absorbeert of zendt het geen licht uit. Maar als het van een hogere energiebaan naar een lagere springt, doet het dat..
De frequentie f van het uitgezonden licht hangt af van het verschil tussen de energieniveaus van de banen:
E = hf = Eeerste - E.laatste
Beperkingen
Het Bohr-model heeft bepaalde beperkingen:
-Het wordt alleen met succes toegepast op het waterstofatoom. Pogingen om het toe te passen op complexere atomen waren niet succesvol.
-Het geeft geen antwoord waarom sommige banen stabiel zijn en andere niet. Het feit dat de energie in het atoom gekwantiseerd was, werkte heel goed, maar het model gaf geen reden, en dat was iets dat wetenschappers ongemak bezorgde..
-Een andere belangrijke beperking is dat het de extra lijnen die worden uitgezonden door atomen in de aanwezigheid van elektromagnetische velden (Zeeman-effect en Stark-effect) niet verklaart. Of waarom sommige lijnen van het spectrum intenser waren dan andere.
-Het Bohr-model houdt ook geen rekening met relativistische effecten, waarmee rekening moet worden gehouden, aangezien experimenteel is vastgesteld dat elektronen in staat zijn om snelheden te bereiken die vrij dicht bij die van licht in een vacuüm liggen..
-Het veronderstelt dat het mogelijk is om de positie en snelheid van het elektron precies te weten, maar wat feitelijk wordt berekend, is de kans dat het elektron een bepaalde positie inneemt..
Ondanks zijn beperkingen was het model destijds zeer succesvol, niet alleen voor het integreren van nieuwe ontdekkingen met reeds bekende elementen, maar ook omdat het nieuwe vragen opriep, waardoor duidelijk werd dat de weg naar een bevredigende verklaring van het atoom in de kwantummechanica lag..
Artikelen van belang
Het atomaire model van Schrödinger.
Atomic de Broglie-model.
Chadwick Atomic Model.
Atoommodel van Heisenberg.
Perrin's atomaire model.
Thomson's atomaire model.
Atoommodel van Dalton.
Atoommodel van Dirac Jordan.
Atoommodel van Democritus.
Atoommodel van Leucippus.
Atoommodel van Sommerfeld.
Huidig atomair model.
Referenties
- Bauer, W. 2011. Physics for Engineering and Sciences. Deel 2. Mc Graw Hill.
- Bohr's atomaire model. Hersteld van: sgpwe.izt.uam.mx.
- Serway, R. (2008). Physics for Science and Engineering. Deel 2. 7e. Ed. Cengage Learning.
- Thomas Griffith, W. 2007. Conceptuele fysica. Mcgraw heuvel.
- Tomé, C. De beperkingen van het Bohr-model. Notebooks of Scientific Culture. Hersteld van: culturacientifica.com.


Niemand heeft nog op dit artikel gereageerd.