
Rutherfords atomaire modelgeschiedenis, experimenten, postulaten

De Atoommodel van Rutherford is de beschrijving van het atoom gecreëerd door de Britse natuurkundige Ernest Rutherford (1871-1937) toen hij in 1911 de atoomkern ontdekte, dankzij de beroemde verstrooiingsexperimenten die zijn naam dragen.
Het idee van het atoom ("ondeelbaarIn het Grieks) als het kleinste onderdeel van de materie, was het een intellectuele schepping geboren in het oude Griekenland, rond 300 voor Christus. Zoals zoveel andere Griekse concepten, is het concept van het atoom ontwikkeld op basis van logica en argumentatie, maar niet op experimenten..
De meest opmerkelijke atomistische filosofen waren Democritus van Abdera (460 - 360 v.Chr.), Epicurus van Samos (341 - 270 v.Chr.) En Titus Lucretius (98 - 54 v.Chr.). De Grieken bedachten vier verschillende soorten atomen die overeenkwamen met de vier elementen waaruit volgens hen materie bestond: lucht, water, aarde en vuur..
Later zou Aristoteles een vijfde element toevoegen: de ether die de sterren vormde, aangezien de andere vier elementen puur aards waren..
De veroveringen van Alexander de Grote, van wie Aristoteles een leraar was, breidden zijn geloof uit over de hele oude wereld, van Spanje tot India en dus eeuwenlang het idee van atoom creëerde een eigen plek in de wereld van de wetenschap.
Artikel index
- 1 Het atoom is niet langer ondeelbaar
- 1.1 Crookes buis
- 2 De ontdekking van het elektron
- 3 Rutherford-verstrooiingsexperimenten: de atoomkern en het proton
- 3.1 Waarnemingen
- 4 Postulaten van het atomaire model van Rutherford
- 5 Beperkingen
- 6 artikelen van belang
- 7 referenties
Het atoom is niet langer ondeelbaar
De ideeën van de Griekse filosofen over de structuur van materie hielden honderden jaren stand, totdat een Engelse scheikundige en schoolleraar genaamd John Dalton (1776-1844) in 1808 de resultaten van zijn experimenten publiceerde..
Dalton was het ermee eens dat elementen bestaan uit extreem kleine deeltjes, atomen genaamd. Maar hij ging verder door te stellen dat alle atomen van hetzelfde element gelijk zijn, dezelfde grootte, dezelfde massa en dezelfde chemische eigenschappen hebben, waardoor ze tijdens een chemische reactie onveranderd blijven..
Dit is het eerste wetenschappelijk onderbouwde atomaire model. Net als de Grieken bleef Dalton het atoom beschouwen als ondeelbaar en ontbrak het daarom aan structuur. Het genie van Dalton bracht hem er echter toe om een van de grote natuurbeschermingsprincipes in acht te nemen:
- Bij chemische reacties, atomen worden niet gemaakt of vernietigd, ze veranderen alleen hun distributie.
En hij stelde de manier vast waarop chemische verbindingen werden gevormd door "samengestelde atomen" (moleculen):
- Wanneer twee of meer atomen van verschillende elementen worden gecombineerd om dezelfde verbinding te vormen, doen ze dat altijd in massaverhoudingen duidelijk en constant.
De 19e eeuw was de grote eeuw van elektriciteit en magnetisme. Een paar jaar na de publicaties van Dalton werpen de resultaten van enkele experimenten twijfel op bij wetenschappers over de ondeelbaarheid van het atoom..
Crookes buis
De Crookes-buis was een apparaat ontworpen door de Britse chemicus en meteoroloog William Crookes (1832-1919). Het experiment dat Crookes in 1875 uitvoerde, bestond uit het plaatsen, in een buis gevuld met gas onder lage druk, twee elektroden, een genaamd kathode en een ander belde anode.
Door een potentiaalverschil tussen de twee elektroden vast te stellen, gloeide het gas met een kleur die kenmerkend was voor het gebruikte gas. Dit feit suggereerde dat er een bepaalde specifieke organisatie binnen het atoom bestond en dat deze daarom niet ondeelbaar was..
Bovendien veroorzaakte deze straling een zwakke fluorescentie op de wand van de glazen buis vóór de kathode, waardoor de schaduw van een kruisvormig merkteken in de buis werd weggesneden..
Het was een mysterieuze straling, bekend als "kathodestralen", die in een rechte lijn naar de anode reisde en zeer energiek was, mechanische effecten kon veroorzaken en die werd afgebogen naar een positief geladen plaat of ook door magneten..
De ontdekking van het elektron
De straling in de Crookes-buis kon geen golven zijn, omdat deze een negatieve lading had. Joseph John Thomson (1856 - 1940) kwam met het antwoord in 1887 toen hij het verband ontdekte tussen de lading en de massa van deze straling, en ontdekte dat het altijd hetzelfde was: 1,76 x 10elf C / Kg., Ongeacht het gas dat in de buis zit of het materiaal dat wordt gebruikt om de kathode te vervaardigen.
Thomson noemde deze deeltjes bloedlichaampjes. Door zijn massa te meten in relatie tot zijn elektrische lading, concludeerde hij dat elk bloedlichaampje veel kleiner was dan een atoom. Daarom stelde hij voor dat ze hier deel van moesten uitmaken, waardoor hij de elektron.
De Britse wetenschapper was de eerste die een grafisch model van het atoom schetste, door een bol met ingevoegde punten te tekenen, die vanwege zijn vorm de bijnaam "pruimenpudding" kreeg. Maar deze ontdekking riep andere vragen op:
- Als de materie neutraal is en het elektron een negatieve lading heeft: in welk deel van het atoom bevindt zich de positieve lading die de elektronen neutraliseert??
- Als de massa van het elektron kleiner is dan die van het atoom, waaruit bestaat dan de rest van het atoom??
- Waarom waren de aldus verkregen deeltjes altijd elektronen en nooit een ander type??
Rutherford-verstrooiingsexperimenten: de atoomkern en het proton
In 1898 had Rutherford twee soorten straling van uranium geïdentificeerd, die hij noemde alpha Y bèta.
Natuurlijke radioactiviteit was al in 1896 ontdekt door Marie Curie. Alfadeeltjes zijn positief geladen en zijn gewoon heliumkernen, maar toen was het concept van een kern nog niet bekend. Rutherford stond op het punt erachter te komen.
Een van de experimenten die Rutherford in 1911 uitvoerde aan de Universiteit van Manchester, met de hulp van Hans Geiger, bestond uit het bombarderen van een dunne laag goud met deeltjes alpha, wiens lading positief is. Rondom de gouden folie plaatste hij een fluorescerend scherm waarmee ze de effecten van het bombardement konden visualiseren..
Observaties
Bij het bestuderen van de effecten op het fluorescerende scherm, merkten Rutherford en zijn assistenten op dat:
- Een zeer hoog percentage van de alfadeeltjes ging zonder merkbare afwijking door de plaat.
- Sommige weken af in vrij steile hoeken
- En heel weinigen stuiterden helemaal terug
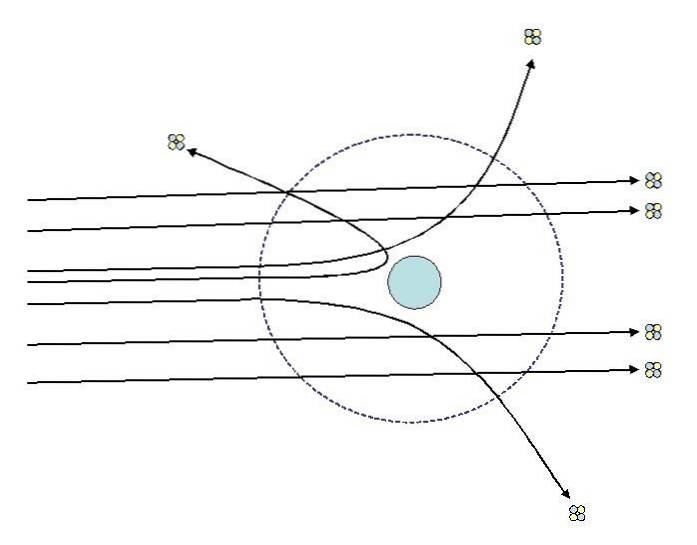
Waarnemingen 2 en 3 verrasten de onderzoekers en brachten hen ertoe aan te nemen dat de persoon die verantwoordelijk is voor de verstrooiing van de stralen een positieve lading moet hebben en dat die verantwoordelijke op grond van waarneming nummer 1 veel kleiner was dan die van de alfadeeltjes..
Rutherford zei er zelf over dat het was "... alsof je een 15-inch marineprojectiel op een vel papier afvuurde en het projectiel terugkaatste en je raakte." Dit kon zeker niet verklaard worden door het Thompson-model.
Bij het analyseren van zijn resultaten vanuit het klassieke standpunt, had Rutherford het bestaan van de atoomkern ontdekt, waar de positieve lading van het atoom geconcentreerd was, waardoor het zijn neutraliteit kreeg..
Rutherford zette zijn verstrooiingsexperimenten voort. In 1918 was het nieuwe doelwit voor alfadeeltjes stikstofgasatomen..
Op deze manier ontdekte hij waterstofkernen en wist meteen dat de enige plaats waar deze kernen vandaan konden komen, was van stikstof zelf. Hoe was het mogelijk dat waterstofkernen deel uitmaakten van stikstof??
Rutherford suggereerde toen dat de kern van waterstof, een element dat al atoomnummer 1 heeft gekregen, een fundamenteel deeltje moet zijn. ik bel haar proton, Grieks woord om aan te duiden Eerste. De ontdekkingen van de atoomkern en het proton zijn dus te danken aan deze briljante Nieuw-Zeelander.
Rutherfords atomaire model postuleert
Het nieuwe model was heel anders dan de Thompson. Dit waren zijn postulaten:
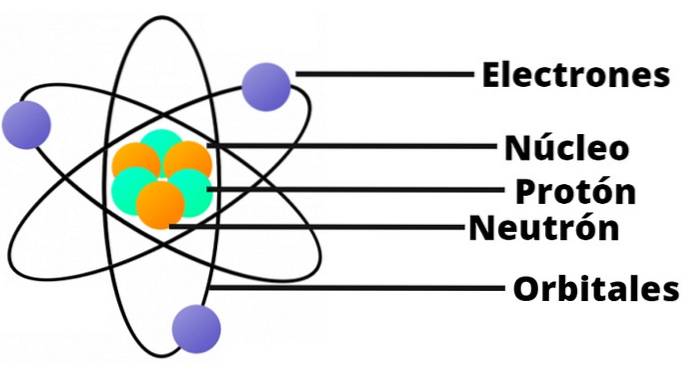
- Het atoom bevat een positief geladen kern, die, ondanks dat hij erg klein is, bijna de volledige massa van het atoom bevat.
- Elektronen draaien op grote afstanden rond de atoomkern en in cirkelvormige of elliptische banen.
- De netto lading van het atoom is nul, aangezien de ladingen van de elektronen de positieve lading in de kern compenseren..
Rutherfords berekeningen wezen op een kern met een bolvorm en een straal zo klein als 10-vijftien m, de waarde van de atoomstraal is ongeveer 100.000 keer groter, aangezien de kernen relatief ver uit elkaar liggen: in de orde van 10-10 m.

Dit verklaart waarom de meeste alfadeeltjes soepel door de plaat gingen of weinig of geen doorbuiging hadden..
Gezien op de schaal van alledaagse objecten, zou het Rutherford-atoom bestaan uit een kern ter grootte van een honkbal, terwijl de atoomstraal ongeveer 8 km zou zijn, waardoor het atoom bijna alles als lege ruimte kan worden beschouwd..
Dankzij zijn gelijkenis met een miniatuurzonnestelsel, werd het bekend als het 'planetaire model van het atoom'. De elektrostatische aantrekkingskracht tussen de kern en elektronen zou analoog zijn aan de aantrekkingskracht tussen de zon en de planeten..
Beperkingen
Er waren echter bepaalde meningsverschillen over enkele waargenomen feiten:
- Als het idee wordt geaccepteerd dat het elektron rond de kern draait, gebeurt het dat het elektron continu straling moet uitzenden totdat het in botsing komt met de kern, met de daaruit voortvloeiende vernietiging van het atoom binnen een seconde. Dit is gelukkig niet wat er werkelijk gebeurt.
- Bovendien zendt het atoom in bepaalde gevallen bepaalde frequenties van elektromagnetische straling uit wanneer er overgangen zijn tussen een staat van hogere energie naar een staat met lagere energie, en alleen die frequenties, niet andere. Hoe te verklaren dat energie wordt gekwantiseerd?
Ondanks deze beperkingen en het feit dat er tegenwoordig veel geavanceerdere modellen zijn die in overeenstemming zijn met de waargenomen feiten, is het atomaire model van Rutherford nog steeds nuttig voor de student om een eerste succesvolle benadering van het atoom en zijn samenstellende deeltjes te hebben..
In dit model van het atoom komt het neutron niet voor, een ander bestanddeel van de kern, dat pas in 1932 werd ontdekt.
Kort nadat Rutherford zijn planetaire model had voorgesteld, zou de Deense natuurkundige Niels Bohr het in 1913 aanpassen om uit te leggen waarom het atoom niet vernietigd is en we zijn hier nog steeds om dit verhaal te vertellen..
Artikelen van belang
Het atomaire model van Schrödinger.
Atomic de Broglie-model.
Chadwick Atomic Model.
Atoommodel van Heisenberg.
Perrin's atomaire model.
Thomson's atomaire model.
Atoommodel van Dirac Jordan.
Atoommodel van Democritus.
Bohr atomair model.
Atoommodel van Dalton.
Referenties
- Rex, A. 2011. Physics Fundamentals. Pearson. 618-621.
- Zapata, F. 2007. Class notes voor de leerstoel Radiobiologie en Stralingsbescherming. School of Public Health van de Centrale Universiteit van Venezuela.


Niemand heeft nog op dit artikel gereageerd.