
Magnesiumhydroxidestructuur, eigenschappen, nomenclatuur, gebruik
De magnesium hydroxide is een anorganische verbinding waarvan de chemische formule Mg (OH) istwee. In zijn pure vorm is het een matwitte vaste stof met een amorf uiterlijk; Met een klein en exact gehalte aan onzuiverheden verandert het echter in het kristallijne vaste bruciet, een mineraal dat in bepaalde afzettingen in de natuur voorkomt, en het is een rijke bron van magnesium..
Het is een zwakke elektrolyt of base, dus de dissociatie ervan is laag in water. Deze eigenschap maakt Mg (OH)twee een goede zuurneutralisator voor menselijke consumptie; remedie in de volksmond bekend als melk van magnesiumoxide-suspensie. Het is ook een brandvertrager door water vrij te geven tijdens zijn thermische ontleding..

In de bovenste afbeelding worden enkele vaste stoffen van magnesiumhydroxide getoond, waarin de ondoorzichtige witte kleur kan worden gewaardeerd. Hoe meer kristallijn ze zijn, ze ontwikkelen glasachtige en parelachtige oppervlakken.
De kristallijne structuur is bijzonder omdat het dubbellaagse hexagonale kristallen vormt, die veelbelovende ontwerpen zijn voor het ontwerp van nieuwe materialen. In deze lagen spelen hun positieve ladingen een belangrijke rol door de vervanging van Mgtwee+ door driewaardige kationen, en de soort opgesloten tussen de muren samengesteld uit OH-anionen-.
Anderzijds zijn andere toepassingen afhankelijk van de morfologie van de bereide deeltjes of nanodeeltjes; als katalysatoren of adsorbentia. In alle gevallen wordt de verhouding van 1: 2 voor Mg-ionen constant gehouden.twee+: OH-, weerspiegeld in dezelfde formule Mg (OH)twee.
Artikel index
- 1 Structuur
- 1.1 Formule en octaëder
- 1.2 Dubbele laag
- 1.3 Morfologieën
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molaire massa
- 2.3 Dichtheid
- 2.4 Smeltpunt
- 2.5 Oplosbaarheid in water
- 2.6 Brekingsindex
- 2,7 pH
- 2.8 Warmtecapaciteit
- 3 Waar bevindt het zich?
- 4 Nomenclatuur
- 5 toepassingen
- 5.1 Neutralisator
- 5.2 Antacidum
- 5.3 Brandvertragend
- 5.4 Katalysator
- 5.5 Adsorbens
- 6 referenties
Structuur
Formule en octaëder
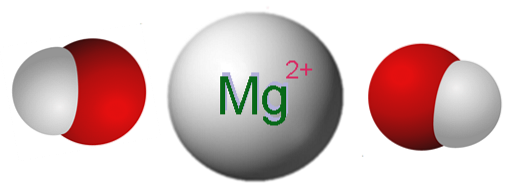
De afbeelding hierboven toont de ionen waaruit Mg (OH) bestaattwee. Zoals te zien is, zijn er twee OH-anionen- voor elk Mg-kationtwee+, die elektrostatisch samenwerken om een kristal met een hexagonale structuur te definiëren. Dezelfde formule geeft aan dat de Mg: OH-verhouding 1: 2 is.
De echte kristalstructuur is echter iets ingewikkelder dan het aannemen van eenvoudige Mg-ionen.twee+ en OH-. Magnesium wordt zelfs gekenmerkt door een coördinatiegetal van 6, dus het kan een interactie aangaan met maximaal zes OH-.
Zo wordt de octaëder Mg (OH) gevormd6, waar de zuurstofatomen duidelijk afkomstig zijn van de OH-en de kristalstructuur berust nu op de overweging van zulke octaëders en hoe ze met elkaar omgaan.
In feite zijn de eenheden Mg (OH)6 uiteindelijk het definiëren van dubbellaagse structuren die op hun beurt in de ruimte zijn gerangschikt om het hexagonale kristal te laten ontstaan.
Dubbele laag
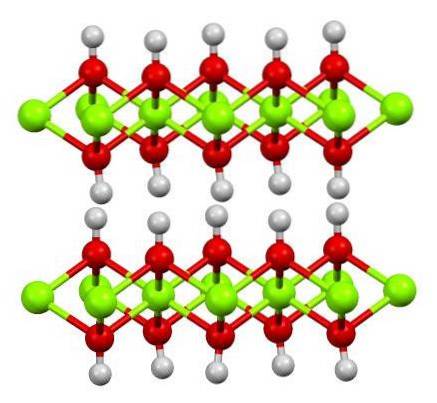
De bovenste afbeelding toont de dubbellaagse structuur van magnesiumhydroxide (LDH): Gelaagde dubbele hydroxidenDe groene bollen stellen Mg-ionen voortwee+, die kunnen worden vervangen door anderen met een hogere lading om een positieve lading in de laag te genereren.
Merk op dat rond elke Mgtwee+ er zijn zes rode bollen verbonden met hun respectievelijke witte bollen; dat wil zeggen, de octaëdrische eenheden Mg (OH)6. De OH- fungeert als een brug om twee Mgtwee+ van verschillende vlakken, waardoor de lagen met elkaar verweven zijn.
Evenzo wordt opgemerkt dat waterstofatomen op en neer wijzen en primair verantwoordelijk zijn voor de intermoleculaire krachten die de twee lagen Mg (OH) -eenheden bij elkaar houden.6.
Neutrale moleculen (zoals alcoholen, ammoniak en stikstof) of zelfs anionen kunnen zich tussen deze lagen nestelen, afhankelijk van hoe positief ze zijn (als er Al-ionen zijn3+ o Geloof3+ ter vervanging van Mgtwee+De "vulstof" van deze soorten wordt beperkt door de oppervlakken die zijn samengesteld uit de OH-anionen-.
Morfologieën
Dubbellaags, zeshoekig glas groeit langzaam of snel. Het hangt allemaal af van de synthese- of bereidingsparameters: temperatuur, molaire verhouding, roeren, oplosmiddelen, reagentia als bron van magnesium, basen of precipitatiemiddelen, enz. Naarmate het kristal groeit, bepaalt het de microstructuur of morfologie van zijn nanodeeltjes of aggregaten.
Deze nanodeeltjes kunnen dus bloemkoolachtige plaat-, plaatjes- of bolletjesachtige morfologieën hebben. Evenzo kan de verdeling van hun groottes veranderen, evenals de mate van poreusheid van de resulterende vaste stoffen..
Eigendommen
Fysiek uiterlijk
Het is een witte, korrelige of poedervormige vaste stof en geurloos.
Molaire massa
58,3197 g / mol.
Dichtheid
3,47 g / ml.
Smeltpunt
350 ° C. Bij deze temperatuur valt het uiteen in oxide door de watermoleculen in de kristallen vrij te geven:
Mg (OH)twee(s) => MgO (s) + HtweeO (g)
Oplosbaarheid in water
0,004 g / 100 ml bij 100 ° C; dat wil zeggen, het lost nauwelijks op in kokend water, waardoor het een onoplosbare verbinding in water is. Als de pH echter afneemt (of de zuurgraad toeneemt), neemt de oplosbaarheid toe door de vorming van het waterige complex Mg (OHtwee6.
Aan de andere kant, als de Mg (OH)twee heeft CO opgenomentwee, zal vastgehouden gas afgeven als bruisen wanneer het wordt opgelost in een zuur medium.
Brekingsindex
1.559
pH
Een waterige suspensie daarvan heeft een pH die varieert tussen 9,5 en 10,5. Hoewel deze waarden normaal zijn, weerspiegelt het de lage basiciteit ervan in vergelijking met andere metaalhydroxiden (zoals NaOH).
Warmte capaciteit
77,03 J / mol K
Waar bevindt het zich?

Magnesiumhydroxide komt in de natuur voor als het mineraal bruciet, dat wordt gekenmerkt door zijn transparante witte kleur, met groene of blauwachtige tinten, afhankelijk van de onzuiverheden. Evenzo maakt bruciet deel uit van sommige kleien, zoals chloriet, omdat het is ingeklemd tussen de lagen silicaten, verbonden door metaalionen..
In bruciet zitten naast Mg nog andere ionentwee+, zoals Al3+, Geloof3+, Zntwee+ en Mntwee+. De ertsen zijn te vinden in verschillende regio's of meren van Schotland, Canada, Italië en de VS..
Fysiek zien de kristallen eruit als gesmolten glas (bovenste afbeelding), met witte, grijsachtige, blauwachtige of groenachtige kleuren, en transparant in zeldzame exemplaren.
Dit mineraal is een van de kwaden die cement en beton aantasten, omdat het de neiging heeft uit te zetten en breuken erin kan veroorzaken. Het neemt echter geen CO optwee, dus het calcineren ervan draagt niet bij aan het broeikaseffect en daarom is het een geschikte mineralogische bron (en de rijkste) om magnesium te verkrijgen, naast zeewater.
Nomenclatuur
Mg (OH)twee Het heeft maximaal drie IUPAC-geaccepteerde namen (buiten mineralogie of geneeskunde). Deze lijken erg op elkaar, aangezien de manier waarop ze eindigen nauwelijks varieert..
'Magnesiumhydroxide' komt bijvoorbeeld overeen met de naam volgens de standaardnomenclatuur, waarbij (II) aan het einde wordt weggelaten omdat +2 bijna standaard de enige oxidatietoestand van magnesium is.
'Magnesiumdihydroxide', waarmee het aantal OH-ionen wordt aangeduid met het Griekse voorvoegsel van de teller- aangegeven in de formule volgens de systematische nomenclatuur. En 'magnesiumhydroxide', eindigend met het achtervoegsel -ico omdat het de maximale en "enige" oxidatietoestand van magnesium is, volgens de traditionele nomenclatuur..
De andere namen, zoals bruciet of melkmagnesia, hoewel ze rechtstreeks verband houden met deze verbinding, is het niet aan te raden ernaar te verwijzen als het gaat om de zuiverste vaste stof of als een anorganische verbinding (reagens, grondstof, enz.).
Toepassingen
Neutralisator
Mg (OH)twee Het dankt zijn lage oplosbaarheid in water aan het feit dat het een uitstekende zuurneutralisator is; anders zou het het medium basisch maken door hoge concentraties OH-ionen te leveren-, net als andere basen (sterke elektrolyten).
Dus Mg (OH)twee geeft nauwelijks OH vrij-, terwijl ze reageren met H-ionen3OF+ om het waterige complex van magnesium te vormen, ook hierboven genoemd. Omdat het de zuurgraad van waterige media kan neutraliseren, is het bedoeld voor de behandeling van afvalwater.
Het is ook een toevoeging aan voedsel, meststoffen en bepaalde producten voor persoonlijke hygiëne, zoals tandpasta, omdat het de zuurgraad ervan vermindert..
Antacidum
Omdat het enigszins oplosbaar is in water, kan het worden ingenomen zonder de effecten van de OH-ionen te riskeren- (dissocieert zeer weinig als een zwakke elektrolyt).
Dit kenmerk, gekoppeld aan de bovenstaande subsectie, maakt het een antacidum voor de behandeling van brandend maagzuur, gastro-intestinale aandoeningen, indigestie en obstipatie, verkocht onder de formule van magnesiummelk.
Aan de andere kant helpt magnesiummelk ook bij het bestrijden van vervelende aften (de witte en rode zweren die in de mond verschijnen).
Brandvertragend
In het eigenschappengedeelte werd vermeld dat Mg (OH)twee ontleedt waarbij water vrijkomt. Juist, dit water helpt om de voortgang van de vlammen te stoppen, aangezien ze warmte absorberen om te verdampen en op hun beurt de dampen de brandbare of ontvlambare gassen verdunnen..
Brucietmineraal wordt hiervoor meestal industrieel gebruikt, bestemd als vulstof in bepaalde materialen, zoals kunststoffen van verschillende polymeren (PVC, harsen, rubbers), kabels of plafonds..
Katalysator
Mg (OH)twee gesynthetiseerd als nanoplaten, is aangetoond dat het efficiënt is in het katalyseren van chemische reducties; bijvoorbeeld dat van 4-nitrofenol (Ph-NOtwee) tot 4-aminofenol (Ph-NHtweeZe hebben ook een antibacteriële werking, dus het kan als therapeutisch middel worden gebruikt..
Adsorbens
Enkele vaste stoffen van Mg (OH)twee ze kunnen behoorlijk poreus zijn, afhankelijk van de bereidingswijze. Daarom vinden ze toepassing als adsorbentia.
In waterige oplossingen kunnen ze (op hun oppervlak) de kleurstofmoleculen adsorberen, waardoor het water helder wordt. Ze zijn bijvoorbeeld in staat de indigokarmijnkleurstof die in waterstromen aanwezig is, te adsorberen..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Magnesium hydroxide. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2019). Magnesium hydroxide. PubChem-database. CID = 14791. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Amethyst Galleries. (2014). Het mineraal bruciet. Hersteld van: galleries.com
- Henrist et al. (2003). Morfologische studie van magnesiumhydroxide-nanodeeltjes
- neergeslagen in verdunde waterige oplossing. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad R. S. (2018). Synthese en structurele analyse van mesoporeuze magnesiumhydroxide nanodeeltjes als efficiënte katalysator.
- Thimmasandra Narayan Ramesh en Vani Pavagada Sreenivasa. (2015). Verwijdering van indigokarmijnkleurstof uit waterige oplossing met behulp van magnesiumhydroxide als adsorptiemiddel. Journal of Materials, vol. 2015, artikel-ID 753057, 10 pagina's. doi.org/10.1155/2015/753057



Niemand heeft nog op dit artikel gereageerd.