
Thomson's atomaire modelkenmerken, postulaten, subatomaire deeltjes

De Thomson's atomaire model Het is gemaakt door de beroemde Engelse natuurkundige J. J. Thomson, die het elektron ontdekte. Voor deze ontdekking en zijn werk op het gebied van elektrische geleiding in gassen ontving hij de Nobelprijs voor natuurkunde in 1906.
Uit zijn werk met kathodestralen werd duidelijk dat het atoom geen ondeelbare entiteit was, zoals Dalton in het vorige model had gepostuleerd, maar dat het een welomschreven interne structuur bevatte..
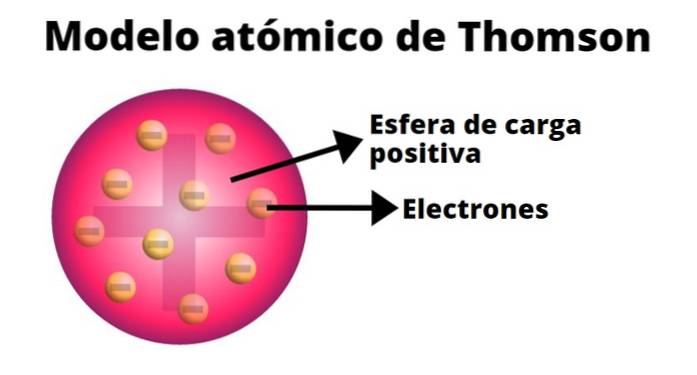
Thomson maakte een model van het atoom op basis van de resultaten van zijn experimenten met kathodestralen. Daarin stelde hij dat het elektrisch neutrale atoom bestond uit positieve en negatieve ladingen van gelijke grootte..
Artikel index
- 1 Hoe heette het atomaire model van Thomson en waarom?
- 2 Kenmerken en postulaten van het Thomson-model
- 2.1 Kathodestralen
- 3 Subatomaire deeltjes uit het atomaire model van Thomson
- 3.1 Crookes-buis
- 3.2 Geladen deeltjes in uniforme elektrische en magnetische velden
- 4 Het Thomson-experiment
- 4.1 De lading-massa-relatie van het elektron
- 5 Verschillen tussen Thomson- en Dalton-modellen
- 6 Modelfouten en beperkingen
- 7 artikelen van belang
- 8 referenties
Hoe heette het atomaire model van Thomson en waarom?
Volgens Thomson was de positieve lading over het atoom verdeeld en waren de negatieve ladingen erin ingebed als rozijnen in een pudding. Uit deze vergelijking kwam de term "rozijnenpudding", zoals het model informeel bekend was..

Hoewel Thomsons idee er vandaag vrij primitief uitziet, vertegenwoordigde het voor die tijd een nieuwe bijdrage. Tijdens het korte leven van het model (van 1904 tot 1910) had het de steun van veel wetenschappers, hoewel vele anderen het als ketterij beschouwden.
Eindelijk kwam er in 1910 nieuw bewijs naar voren over de atomaire structuur, en het model van Thomson viel snel opzij. Dit gebeurde zodra Rutherford de resultaten publiceerde van zijn verstrooiingsexperimenten, die het bestaan van de atoomkern onthulden..
Thomsons model was echter het eerste dat het bestaan van subatomaire deeltjes postuleerde en de resultaten waren het resultaat van fijne en rigoureuze experimenten. Op deze manier schiep hij het precedent voor alle ontdekkingen die volgden..
Kenmerken en postulaten van het Thomson-model
Thomson kwam tot zijn atoommodel op basis van verschillende waarnemingen. De eerste was dat de röntgenstralen die onlangs door Roentgen werden ontdekt, luchtmoleculen konden ioniseren. Tot dan was de enige manier om te ioniseren door ionen in een oplossing chemisch te scheiden..
Maar de Engelse fysicus slaagde erin om zelfs mono-atomaire gassen zoals helium met succes te ioniseren met behulp van röntgenstralen. Dit deed hem geloven dat de lading in het atoom kon worden gescheiden, en dat het daarom niet ondeelbaar was. Hij merkte ook op dat kathodestralen dat wel konden. worden afgebogen door elektrische en magnetische velden.

Daarom bedacht Thomson een model dat correct verklaarde dat het atoom elektrisch neutraal is en dat kathodestralen bestaan uit negatief geladen deeltjes..
Met behulp van experimenteel bewijs typeerde Thomson het atoom als volgt:
-Het atoom is een elektrisch neutrale vaste bol met een straal van ongeveer 10-10 m.
-De positieve lading wordt min of meer gelijkmatig over de bol verdeeld.
-Het atoom bevat negatief geladen "bloedlichaampjes", die zijn neutraliteit verzekeren..
-Deze bloedlichaampjes zijn voor alle materie hetzelfde.
-Als het atoom in evenwicht is, is dat zo n bloedlichaampjes regelmatig gerangschikt in ringen binnen de sfeer van positieve lading.
-De massa van het atoom is gelijkmatig verdeeld.
Kathodestralen

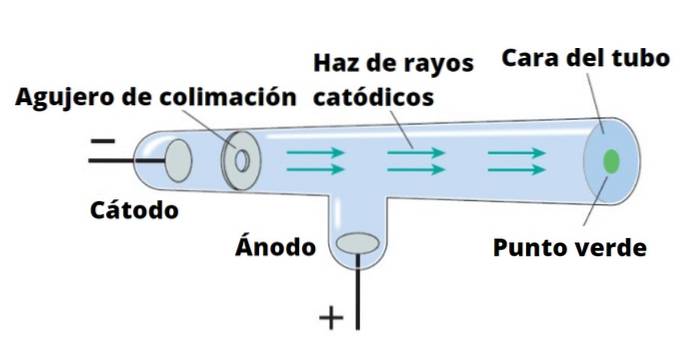
Thomson voerde zijn experimenten uit met kathodestralen, ontdekt in 1859. Kathodestralen zijn bundels negatief geladen deeltjes. Om ze te produceren, worden vacuümglazen buizen gebruikt, waarin twee elektroden worden geplaatst, genaamd kathode Y anode.
Vervolgens wordt een elektrische stroom geleid die de kathode opwarmt, die op deze manier onzichtbare straling afgeeft die direct naar de tegenoverliggende elektrode wordt gericht..
Om straling te detecteren, die niets anders is dan kathodestralen, is de wand van de buis achter de anode bedekt met een fluorescerend materiaal. Wanneer de straling daar komt, geeft de wand van de buis een intense helderheid af.
Als een vast voorwerp de kathodestralen in de weg zit, werpt het een schaduw op de wand van de buis. Dit geeft aan dat de stralen in een rechte lijn reizen en ook dat ze gemakkelijk kunnen worden geblokkeerd..
De aard van kathodestralen werd uitvoerig besproken, aangezien hun aard onbekend was. Sommigen dachten dat het golven van het elektromagnetische type waren, terwijl anderen beweerden dat het deeltjes waren..
Subatomaire deeltjes van de Thomson's atomaire model
Het atomaire model van Thomson is, zoals we al zeiden, het eerste dat het bestaan van subatomaire deeltjes postuleert. Thomsons bloedlichaampjes zijn niets anders dan elektronen, de fundamenteel negatief geladen deeltjes van het atoom..
We weten momenteel dat de andere twee fundamentele deeltjes het positief geladen proton en het ongeladen neutron zijn..
Maar deze werden niet ontdekt toen Thomson zijn model ontwikkelde. De positieve lading in het atoom was erin verdeeld, het hield geen rekening met een deeltje dat die lading droeg en op dit moment was er geen bewijs van zijn bestaan.
Om deze reden had zijn model een vluchtig bestaan, aangezien Rutherfords verstrooiingsexperimenten in de loop van een paar jaar de weg baanden voor de ontdekking van het proton. En wat het neutron betreft, Rutherford stelde zelf zijn bestaan voor, enkele jaren voordat het uiteindelijk werd ontdekt..
Crookes buis
Sir William Crookes (1832-1919) ontwierp de buis die zijn naam draagt rond 1870, met de bedoeling de aard van kathodestralen zorgvuldig te bestuderen. Hij voegde elektrische velden en magnetische velden toe en merkte op dat de stralen hierdoor werden afgebogen.
Zo ontdekten Crookes en andere onderzoekers, waaronder Thomson, dat:
- In de kathodestraalbuis werd een elektrische stroom opgewekt
- De stralen werden afgebogen door de aanwezigheid van magnetische velden, op dezelfde manier als negatief geladen deeltjes..
- Elk metaal dat werd gebruikt om de kathode te maken, diende even goed om kathodestralen te produceren, en hun gedrag was onafhankelijk van het materiaal..
Deze waarnemingen voedden de discussie over de oorsprong van kathodestralen. Degenen die beweerden dat het golven waren, waren gebaseerd op het feit dat kathodestralen in een rechte lijn konden reizen. Bovendien verklaarde deze hypothese heel goed de schaduw die een tussenliggend vast object op de wand van de buis wierp en onder bepaalde omstandigheden was het bekend dat de golven fluorescentie konden veroorzaken..
Maar aan de andere kant was het niet duidelijk hoe magnetische velden kathodestralen konden afbuigen. Dit kon alleen worden verklaard als de stralen als deeltjes werden beschouwd, een hypothese die Thomson deelde..
Opgeladen deeltjes in uniforme elektrische en magnetische velden
Een geladen deeltje met lading q ervaart een kracht Fe in het midden van een uniform elektrisch veld E, van grootte:
Fe = qE
Wanneer een geladen deeltje loodrecht een uniform elektrisch veld kruist, zoals dat tussen twee platen met tegengestelde ladingen wordt geproduceerd, ervaart het een afbuiging en bijgevolg een versnelling:
qE = ma
a = qE / m
Aan de andere kant, als het geladen deeltje beweegt met een snelheid van magnitude v, in het midden van een uniform magnetisch veld van magnitude B, heeft de magnetische kracht Fm die het ervaart de volgende intensiteit:
Fm = qvB
Zolang de snelheids- en magnetische veldvectoren loodrecht staan. Wanneer een geladen deeltje loodrecht een homogeen magnetisch veld raakt, ondergaat het ook een afbuiging en is zijn beweging uniform cirkelvormig.
De middelpuntzoekende versnelling bijc in dit geval is het:
qvB = mac
Op zijn beurt is de centripetale versnelling gerelateerd aan de snelheid van het deeltje v en de straal R van het cirkelvormige pad:
naarc = vtwee/ R
Daarom:
qvB = mvtwee/ R
De straal van het cirkelvormige pad kan als volgt worden berekend:
R = mv / qB
Deze vergelijkingen zullen later worden gebruikt om de manier te reconstrueren waarop Thomson de lading-massa-relatie van het elektron heeft afgeleid..
Thomson's experiment
Thomson passeerde een bundel kathodestralen, een bundel elektronen, hoewel hij die nog niet kende, door uniforme elektrische velden. Deze velden worden gecreëerd tussen twee geladen geleidende platen die op een kleine afstand van elkaar zijn gescheiden.
Hij stuurde ook kathodestralen door een uniform magnetisch veld en observeerde het effect dat dit op de straal had. Zowel in het ene veld als in het andere was er een afbuiging in de stralen, waardoor Thomson terecht dacht dat de straal uit geladen deeltjes bestond..
Om dit te verifiëren, voerde Thomson verschillende strategieën uit met kathodestralen:
- Hij varieerde de elektrische en magnetische velden totdat de krachten wegvielen. Op deze manier gingen de kathodestralen door zonder dat ze doorbuiging ondervonden. Door de elektrische en magnetische krachten gelijk te stellen, kon Thomson de snelheid van de deeltjes in de bundel bepalen.
- Het annuleerde de intensiteit van het elektrische veld, op deze manier volgden de deeltjes een cirkelvormig pad in het midden van het magnetische veld.
- Hij combineerde de resultaten van stap 1 en 2 om het verband tussen lading en massa van de "bloedlichaampjes" te bepalen..
De lading-massaverhouding van het elektron
Thomson stelde vast dat de lading-massaverhouding van de deeltjes waaruit de kathodestraalbundel bestaat de volgende waarde heeft:
q / m = 1,758820 x 10 11 C. kg-1.
Waar q staat voor de lading van het "bloedlichaampje", dat eigenlijk het elektron is en m is de massa ervan. Thomson volgde de procedure beschreven in de vorige sectie, die we hier stap voor stap opnieuw maken, met de vergelijkingen die hij gebruikte.

Stap 1
Egaliseer de elektrische kracht en de magnetische kracht, door de straal door de loodrechte elektrische en magnetische velden te laten gaan:
qvB = qE
Stap 2
Bepaal de snelheid die wordt verkregen door de deeltjes in de bundel wanneer ze direct passeren zonder afbuiging:
v = E / B
Stap 3
Annuleer het elektrische veld en laat alleen het magnetische veld over (nu is er afbuiging):
R = mv / qB
Met v = E / B resulteert het:
R = mE / qBtwee
De straal van de baan kan daarom worden gemeten:
q / m = v / RB
O goed:
q / m = E / RBtwee
Volgende stappen
Het volgende dat Thomson deed, was de q / m-verhouding meten met kathodes van verschillende materialen. Zoals eerder vermeld, zenden alle metalen kathodestralen uit met identieke eigenschappen..
Vervolgens vergeleek Thomson zijn waarden met die van de verhouding q / m van het waterstofion, verkregen door elektrolyse en waarvan de waarde ongeveer 1 x 10 is8 C / kg. De lading-massaverhouding van het elektron is ongeveer 1750 keer die van het waterstofion.
Daarom hadden de kathodestralen een veel grotere lading, of misschien een massa veel minder dan die van het waterstofion. Het waterstofion is gewoon een proton, waarvan het bestaan lang na Rutherfords verstrooiingsexperimenten bekend werd..
Tegenwoordig is bekend dat het proton bijna 1800 keer zo zwaar is als het elektron en een lading heeft van dezelfde grootte en tegengesteld teken aan die van het elektron..
Een ander belangrijk detail is dat de experimenten van Thomson niet rechtstreeks de elektrische lading van het elektron bepaalden, noch de waarde van zijn massa afzonderlijk. Deze waarden werden bepaald door de experimenten van Millikan, die in 1906 begonnen..
Modelverschillen van Thomson en Dalton
Het fundamentele verschil tussen deze twee modellen is dat Dalton dacht dat het atoom een bol is. In tegenstelling tot Thomson stelde hij niet het bestaan van positieve of negatieve ladingen voor. Voor Dalton zag een atoom er als volgt uit:

Zoals we eerder hebben gezien, dacht Thomson dat het atoom deelbaar was, en waarvan de structuur wordt gevormd door een positieve bol en elektronen eromheen.
Modelgebreken en beperkingen
Het atomaire model van Thomson slaagde er destijds in om het chemische gedrag van stoffen heel goed te verklaren. Hij legde ook correct de verschijnselen uit die zich in de kathodestraalbuis voordeden.
Maar in feite noemde Thomson zijn deeltjes niet eens "elektronen", hoewel de term al eerder was bedacht door George Johnstone Stoney. Thomson noemde ze gewoon 'bloedlichaampjes'..
Hoewel Thomson gebruik heeft gemaakt van alle kennis die hem destijds tot zijn beschikking had, zijn er verschillende belangrijke beperkingen in zijn model, die al heel vroeg duidelijk werden:
-De positieve lading wordt niet door het atoom verdeeld. Rutherford-verstrooiingsexperimenten toonden aan dat de positieve lading van het atoom noodzakelijkerwijs beperkt is tot een klein gebied van het atoom, dat later bekend werd als de atoomkern..
-Elektronen hebben een specifieke verdeling binnen elk atoom. De elektronen zijn niet gelijkmatig verdeeld, zoals de rozijnen in de beroemde pudding, maar ze hebben een orbitalen orbitalen die latere modellen onthulden.
Het is precies de rangschikking van de elektronen in het atoom die het mogelijk maakt de elementen te ordenen op basis van hun kenmerken en eigenschappen in het periodiek systeem. Dit was een belangrijke beperking van het Thomson-model, dat niet kon verklaren hoe het mogelijk was om de elementen op deze manier te ordenen..
-De atoomkern is degene die de meeste massa bevat. Thomsons model stelde dat de massa van het atoom er gelijkmatig in was verdeeld. Maar vandaag weten we dat de massa van het atoom praktisch geconcentreerd is in de protonen en neutronen van de kern..
Het is ook belangrijk op te merken dat dit model van het atoom het niet mogelijk maakte om het type beweging af te leiden dat de elektronen in het atoom hadden..
Artikelen van belang
Het atomaire model van Schrödinger.
Atomic de Broglie-model.
Chadwick Atomic Model.
Atoommodel van Heisenberg.
Perrin's atomaire model.
Atoommodel van Dalton.
Atoommodel van Dirac Jordan.
Atoommodel van Democritus.
Atoommodel van Leucippus.
Bohr atomair model.
Atoommodel van Sommerfeld.
Huidig atomair model.
Referenties
- Andriessen, M. 2001. HSC-cursus. Natuurkunde 2. Jacaranda HSC Science.
- Arfken, G. 1984. University Physics. Academische pers.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Rex, A. 2011. Physics Fundamentals. Pearson.
- Wikipedia. Thomson's atomaire model. Hersteld van: es.wikipedia.org.



Niemand heeft nog op dit artikel gereageerd.