
Karakteristieke apolaire moleculen, identificatie en voorbeelden
De apolaire moleculen zijn degenen die in hun structuur een symmetrische verdeling van hun elektronen hebben. Dit is mogelijk als het elektronegativiteitsverschil van hun atomen klein is, of als de elektronegatieve atomen of groepen hun effecten op het molecuul vectormatig opheffen..
Niet altijd is "apolariteit" absoluut. Om deze reden worden moleculen met lage polariteit soms als apolair beschouwd; dat wil zeggen, het heeft een dipoolmoment µ dichtbij 0. Hier komen we in het veld van het relatieve: hoe laag moet µ zijn om een molecuul of verbinding als niet-polair te beschouwen??
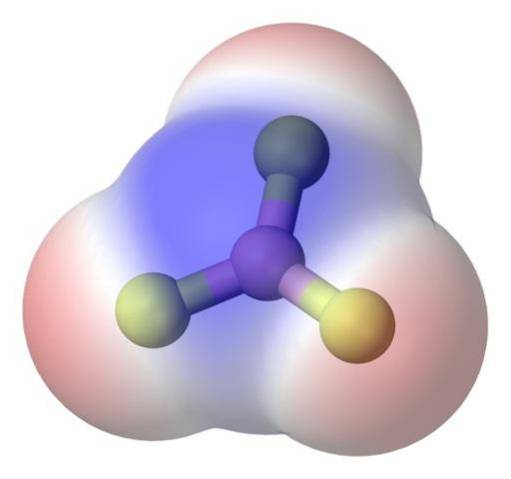
Om het probleem beter aan te pakken, is er het boortrifluoridemolecuul, BF3 (bovenste afbeelding).
Het fluoratoom is veel elektronegatiever dan het booratoom, en daarom zijn de B-F-bindingen polair. Het BF-molecuul3 is symmetrisch (trigonaal vlak) en omvat de vectorannulering van de drie momenten B-F.
Er worden dus ook apolaire moleculen gegenereerd, zelfs als er polaire bindingen bestaan. De gegenereerde polariteit kan worden gecompenseerd door het bestaan van een andere poollink, van dezelfde grootte als de vorige, maar in de tegenovergestelde richting georiënteerd; zoals het gebeurt in de BF3.
Artikel index
- 1 Kenmerken van een apolair molecuul
- 1.1 Symmetrie
- 1.2 Elektronegativiteit
- 1.3 Intermoleculaire krachten
- 2 Hoe ze te identificeren?
- 3 voorbeelden
- 3.1 Edelgassen
- 3.2 Diatomische moleculen
- 3.3 Koolwaterstoffen
- 3.4 Andere
- 4 referenties
Kenmerken van een apolair molecuul
Symmetrie
Om de effecten van polaire bindingen elkaar op te heffen, moet het molecuul een bepaalde geometrische structuur hebben; bijv. lineair, het gemakkelijkst te begrijpen op het eerste gezicht.
Dit is het geval bij kooldioxide (COtwee), die twee polaire bindingen heeft (O = C = O). Dit komt omdat de twee dipoolmomenten van de C = O-bindingen opheffen wanneer de ene naar de ene kant is gericht en de tweede naar de andere, onder een hoek van 180 °..
Daarom is een van de eerste kenmerken waarmee rekening moet worden gehouden bij het evalueren van de "apolariteit" van een molecuul vanuit vogelperspectief, te observeren hoe symmetrisch het is..
Stel dat in plaats van COtwee we hebben het COS-molecuul (O = C = S), carbonylsulfide genaamd.
Nu is het niet langer een apolair molecuul, aangezien de elektronegativiteit van zwavel minder is dan die van zuurstof; en daarom is het dipoolmoment C = S anders dan dat van C = O. Als gevolg hiervan is COS een polair molecuul (hoe polair is een andere kwestie).
De onderstaande afbeelding geeft een grafische samenvatting van alles wat zojuist is beschreven:
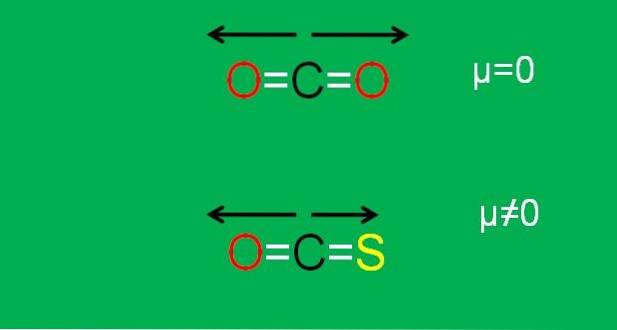
Merk op dat het dipoolmoment van de C = S-binding kleiner is dan dat van de C = O-binding in het COS-molecuul.
Elektronegativiteit
Elektronegativiteit op de Pauling-schaal heeft waarden tussen 0,65 (voor frank) en 4,0 (voor fluor). Halogenen hebben over het algemeen een hoge elektronegativiteit.
Wanneer het verschil in elektronegativiteit van de elementen die een covalente binding vormen kleiner is dan of gelijk is aan 0,4, wordt gezegd dat het niet-polair of niet-polair is. De enige moleculen die echt apolair zijn, zijn echter die gevormd door bindingen tussen identieke atomen (zoals waterstof, H-H)..
Intermoleculaire krachten
Om een stof in water op te lossen, moet deze elektrostatisch in wisselwerking staan met de moleculen; interacties die apolaire moleculen niet kunnen uitvoeren.
In apolaire moleculen zijn hun elektrische ladingen niet beperkt tot één uiteinde van het molecuul, maar zijn ze symmetrisch (of homogeen) verdeeld. Daarom kan het niet interageren door dipool-dipoolkrachten.
In plaats daarvan interageren apolaire moleculen met elkaar door de verstrooiingskrachten van Londen; Dit zijn instantane dipolen die de elektronische wolk van de atomen van naburige moleculen polariseren. Hier is de molecuulmassa een overheersende factor in de fysische eigenschappen van deze moleculen..
Hoe ze te identificeren?
-Misschien is een van de beste methoden om een apolair molecuul te identificeren, de oplosbaarheid ervan in verschillende polaire oplosmiddelen, omdat ze er over het algemeen slecht in oplosbaar zijn..
-Over het algemeen zijn apolaire moleculen gasvormig van aard. Ze kunnen ook zijn om niet-mengbare vloeistoffen met water te vormen.
-Niet-polaire vaste stoffen worden gekenmerkt doordat ze zacht zijn.
-De verspreidingskrachten die ze bij elkaar houden, zijn over het algemeen zwak. Hierdoor zijn hun smelt- of kookpunten meestal lager dan die van verbindingen van polaire aard..
-Niet-polaire moleculen, vooral in vloeibare vorm, zijn slechte geleiders van elektriciteit, omdat ze geen netto elektrische lading hebben..
Voorbeelden
Edele gassen
Hoewel het geen moleculen zijn, worden edelgassen als apolair beschouwd. Als wordt aangenomen dat twee van zijn atomen, He-He, gedurende korte tijd met elkaar in wisselwerking staan, zou deze interactie (half) als een molecuul kunnen worden beschouwd; molecuul dat apolair van aard zou zijn.
Diatomische moleculen
Diatomische moleculen, zoals H.twee, de BRtwee, de iktwee, de Cltwee, de Otwee, en de Ftwee, ze zijn apolair. Deze hebben de algemene formule Atwee, A-A.
Koolwaterstoffen
Wat als A een groep atomen was? Het zou vóór andere apolaire verbindingen zijn; bijvoorbeeld ethaan, CH3-CH3, waarvan het koolstofskelet lineair is, C-C.
Methaan, CH4, en ethaan, CtweeH.6, het zijn apolaire moleculen. Koolstof heeft een elektronegativiteit van 2,55; terwijl de elektronegativiteit van waterstof 2,2 is. Daarom is er een dipoolvector met lage intensiteit, georiënteerd van waterstof naar koolstof..
Maar vanwege de geometrische symmetrie van de methaan- en ethaanmoleculen is de som van de dipoolvectoren of dipoolmomenten in hun moleculen nul, dus er is geen netto lading op de moleculen..
Over het algemeen gebeurt hetzelfde met alle koolwaterstoffen, en zelfs als er onverzadigingen in zitten (dubbele en drievoudige bindingen), worden ze als niet-polaire verbindingen of verbindingen met een lage polariteit beschouwd. Cyclische koolwaterstoffen zijn ook apolaire moleculen, zoals cyclohexaan of cyclobutaan.
Anderen
Moleculen kooldioxide (COtwee) en koolstofdisulfide (CStwee) zijn apolaire moleculen, beide met lineaire geometrie.
In koolstofdisulfide is de elektronegativiteit van koolstof 2,55, terwijl de elektronegativiteit van zwavel 2,58 is; dus beide elementen hebben praktisch dezelfde elektronegativiteit. Er is geen generatie van een dipoolvector en daarom is de nettolading nul.
Evenzo hebben we de volgende CCl-moleculen4 en AlBr3, beide apolair:
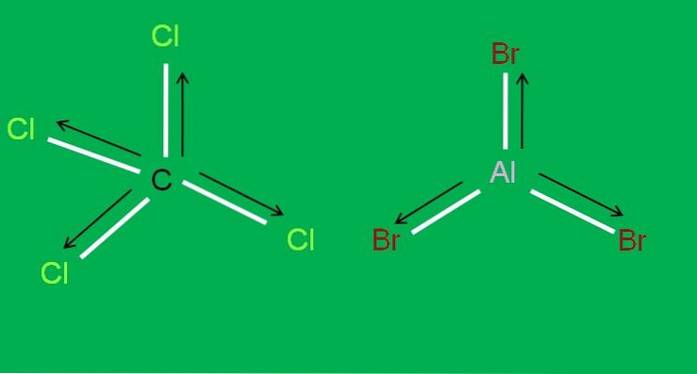
In aluminiumtribromide, AlBr3 hetzelfde gebeurt met de BF3, aan het begin van het artikel. Ondertussen, voor tetrachloorkoolstof, CCl4, de geometrie is tetraëdrisch en symmetrisch, aangezien alle C-Cl-bindingen gelijk zijn.
Evenzo moleculen met de algemene formule CX4 (CF4, CI4 en CBr4), ze zijn ook apolair.
En tot slot kan een apolair molecuul zelfs een octaëdrische geometrie hebben, zoals het geval is met zwavelhexafluoride, SF6. In feite kan het elke geometrie of structuur hebben, zolang het maar symmetrisch is en zijn elektronische distributie homogeen is..
Referenties
- Carey F. A. (2008). Organische chemie. Carbonzuren. (Zesde editie). Mc Graw Hill.
- Cedrón J., Landa V., Robles J. (2011). Moleculaire polariteit. Hersteld van: corinto.pucp.edu.pe
- Tutor View. (2018). Niet-polair molecuul. Hersteld van: chemistry.tutorvista.com
- Helmenstine, Anne Marie, Ph.D. (28 januari 2019). Voorbeelden van polaire en niet-polaire moleculen. Hersteld van: thoughtco.com
- Kurtus R. (19 september 2016). Polaire en niet-polaire moleculen. School voor kampioenen. Hersteld van: school-for-champions.com
- Ganong W. (2004). Medische fysiologie. Probleem 19Th. Geef de moderne handleiding redactioneel.


Niemand heeft nog op dit artikel gereageerd.