
Natriumnitriet (NaNO2) structuur, eigenschappen, gebruik, risico's

De natriumnitraat is een kristallijne anorganische vaste stof gevormd door een natriumion Na+ en een nitrietion NOtwee-. De chemische formule is NaNOtwee. Het is een witte kristallijne vaste stof die de neiging heeft om water uit de omgeving te absorberen, dat wil zeggen dat het hygroscopisch is.
In aanwezigheid van lucht oxideert het langzaam tot natriumnitraat NaNO3. Het heeft oxiderende eigenschappen (het oxideert andere verbindingen) en ook reducerende eigenschappen (het wordt geoxideerd door andere verbindingen).

Het is van nature aanwezig in het menselijk lichaam en wordt gebruikt als conserveermiddel voor gezouten vlees en gerookte vis, omdat het de groei van schadelijke micro-organismen voorkomt..
Het heeft een belangrijke toepassing bij de spoedbehandeling van cyanidevergiftiging, omdat het het toxische en dodelijke effect van deze verbinding vermindert. Het moet echter met grote voorzichtigheid worden toegediend en werkt niet in alle gevallen.
Gebleken is dat het ooginfecties kan voorkomen die worden veroorzaakt door besmetting van contactlenzen door micro-organismen. Sommige onderzoeken geven aan dat de consumptie ervan met voedsel kanker kan veroorzaken, maar er wordt geschat dat dit kan worden vermeden door vitamine C in te nemen met dergelijk voedsel..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3,7 pH
- 3.8 Overige eigenschappen
- 4 Verkrijgen
- 4.1 Aanwezigheid in het lichaam
- 5 toepassingen
- 5.1 In de voedingsindustrie
- 5.2 Als spoedbehandeling bij cyanidevergiftiging
- 5.3 Voor verwijding van bloedvaten
- 5.4 Tegen enkele parasieten
- 5.5 Om orgaanschade te voorkomen
- 5.6 Om infecties door het gebruik van contactlenzen te voorkomen
- 5.7 In verschillende toepassingen
- 6 Risico's of ongemakken
- 7 referenties
Structuur
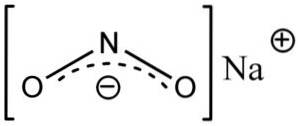
Natriumnitriet bestaat uit het natriumkation Na+ en het nitrietanion NOtwee-.
In het nitrietanion NOtwee- stikstof heeft een valentie van +3 en zuurstof van -2, daarom heeft het anion een enkele globale negatieve lading.
Nitriet anion NOtwee- heeft een hoekige structuur, dat wil zeggen dat de bindingen van stikstof (N) met zuurstofatomen (O) een hoek vormen.
Nomenclatuur
- Natriumnitraat
- Natriumnitraat
- Salpeterigzuur natriumzout.
Eigendommen
Fysieke toestand
Geelachtig witte kristallijne vaste stof. Orthorhombische kristallen.
Molecuulgewicht
68,995 g / mol
Smeltpunt
271 ºC
Kookpunt
Het kookt niet. Het ontleedt boven 320 ºC
Dichtheid
2,17 g / cm3 bij 20 ºC
Oplosbaarheid
Oplosbaar in water: 84,8 g / 100 g water van 25 ºC. Enigszins oplosbaar in ethanol. Matig oplosbaar in methanol. Matig oplosbaar in diethylether.
pH
De waterige oplossingen zijn alkalisch, met een pH van ongeveer 9. Dit komt omdat salpeterig zuur een zwak zuur is dat niet de neiging heeft om te dissociëren, dus het NO-iontwee- probeer een proton H te nemen+ van water om HNO te vormentwee, wat leidt tot de vorming van OH-ionen- die alkaliteit produceren.
NIETtwee- + H.tweeO → HNOtwee + Oh-
Andere eigenschappen
Natriumnitriet NaNOtwee oxideert in aanwezigheid van lucht langzaam tot natriumnitraat NaNO3. Het is een hygroscopische vaste stof, omdat het water uit de omgeving opneemt.
Het heeft oxiderende eigenschappen (het kan andere verbindingen oxideren) en ook reducerende eigenschappen (het kan worden geoxideerd door andere verbindingen).
Als het in contact komt met materialen zoals hout, papier of textiel, kan het gevaarlijk ontbranden..
Bij zuren vindt de afbraak plaats, waarbij een mengsel van bruine giftige gassen van stikstofoxiden (NOX.
Het verkrijgen van
Het kan worden verkregen door natriumnitraat NaNO te verwarmen3 met lood Pb:
Oudere broer3 + Pb → NaNOtwee + PbO
Aanwezigheid in het lichaam
Nitrietanion is van nature aanwezig in bloed en weefsels, omdat het wordt gevormd als gevolg van NO-oxidatie..
Toepassingen
In de voedingsindustrie
Het wordt gebruikt om vlees te marineren, omdat het werkt als een kleur- en smaakbehoudmiddel en als conserveermiddel omdat het de groei van micro-organismen onder controle houdt, waarbij met name de ontwikkeling van Clostridium botulinum het veroorzaken van botulisme.
Natriumnitriet in vlees reageert met hemoglobine in rode bloedcellen of rode bloedcellen in dit voedsel. Wordt ook gebruikt bij gerookte vis.

Als een spoedbehandeling voor cyanidevergiftiging
Natriumnitriet wordt gebruikt om acute cyanidevergiftiging te behandelen. Het is een tegengif voor dit ernstige probleem.
Zijn werking is te wijten aan het feit dat het de vorming van methemoglobine (een soort hemoglobine) in het bloed bevordert, dat cyanide-ionen vasthoudt en niet afgeeft, en dus voorkomt dat ze in cellen worden afgegeven, waardoor ze minder giftig worden.
In het geval van cyanidevergiftiging wordt natriumnitriet intraveneus toegediend, het duurt ongeveer 12 minuten om methemoglobine te genereren. Ondanks deze vertraging biedt het ook bescherming vanwege het vaatverwijdende effect..
Voor het verwijden van bloedvaten
Het wordt gebruikt om pulmonale arteriële hypertensie te behandelen, omdat het werkt door de bloedvaten te verwijden, waardoor de bloeddruk daalt. Geschat wordt dat dit effect te wijten is aan het feit dat het wordt omgezet in stikstofmonoxide NO, dat werkt door de zachte spieren te ontspannen..
De oorzaken van de doeltreffendheid ervan worden echter nog bestudeerd..
Tegen enkele parasieten
Bepaalde onderzoekers ontdekten dat natriumnitriet de groei en vermenigvuldiging van de darmparasiet remt Blastocystis hominis zelfs als het resistent is tegen andere medicijnen.
NaNO werd gevondentwee genereert de dood van deze parasiet door apoptose, wat een soort zelfmoord is van de parasietcel. Natriumnitriet zorgt ervoor dat darmcellen NO produceren, wat belangrijk lijkt in dit proces.
Om orgaanschade te voorkomen
Volgens sommige onderzoeken is nitriet een krachtige remmer van schade aan hart en lever bij ischemische processen (verminderde bloedstroom in een deel van het lichaam). Aangenomen wordt dat dit te wijten is aan het feit dat het een biologische reserve van NO is.
Geconcludeerd werd dat het kan worden gebruikt om orgaanschade te voorkomen na herstel van de bloedstroom die is onderbroken door een hartaanval, een risicovolle buikoperatie of een orgaantransplantatie..
Om infecties door het dragen van contactlenzen te voorkomen
NaNO is gevondentwee voorkomt de vorming van films van pathogene micro-organismen Staphylococcus aureus Y Pseudomonas aeruginosa over contactlenzen.

In verschillende toepassingen
Natriumnitriet wordt gebruikt om kleurstoffen, medicijnen en verschillende organische verbindingen te maken.
Dient ook als corrosieremmer in universele vetten.
Risico's of ongemakken
Een van de problemen bij het gebruik van natriumnitriet voor cyanidevergiftiging is dat het bij kinderen ernstige cardiovasculaire aandoeningen veroorzaakt..
Niet aanbevolen voor slachtoffers van brand bij gelijktijdige blootstelling aan zowel cyanide als koolmonoxide (CO). CO vermindert het vermogen van het bloed om zuurstof te vervoeren, dus de toediening van NaNOtwee zou de zuurstofarme toestand in het bloed van de patiënt verergeren.
Geïnhaleerd natriumnitriet is irriterend en giftig, het kan het cardiovasculaire systeem en het centrale zenuwstelsel beschadigen. Bovendien is het schadelijk voor het milieu.
Natriumnitriet dat met voedsel wordt ingenomen, kan schadelijk zijn. Nitriet reageert bij het bereiken van de maag met bepaalde verbindingen en vormt nitrosaminen, die kanker kunnen veroorzaken.
Deze reacties kunnen worden vermeden in aanwezigheid van vitamine C.
Volgens bepaalde geraadpleegde bronnen is het risico van het consumeren van nitrieten met gezouten vlees of vis minimaal omdat nitriet van nature aanwezig is in speeksel.
De bronnen geven aan dat dit risico ook minimaal is in vergelijking met de grote voordelen van het consumeren van voedsel dat vrij is van schadelijke micro-organismen.
Referenties
- Bhattacharya, R. en Flora, S.J.S. (2015). Cyanide-toxiciteit en de behandeling ervan. In Handbook of Toxicology of Chemical Warfare Agents (Second Edition). Opgehaald van sciencedirect.com.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Natriumnitraat. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Kim, D.J. et al. (2017). De Antibiofilm-werkzaamheid van stikstofmonoxide op zachte contactlenzen. BMC Ophthalmol 17, 206 (2017). Opgehaald van bmcophthalmol.biomedcentral.com.
- Ramis-Ramos, G. (2003). Antioxidanten. Synthetische antioxidanten. In Encyclopedia of Food Sciences and Nutrition (Second Edition). Opgehaald van sciencedirect.
- Barozzi Seabra, A. en Durán, N. (2017). Stikstofoxidedonoren voor de behandeling van verwaarloosde ziekten. Bij stikstofmonoxidedonoren. Opgehaald van sciencedirect.com.
- Duranski, M.R. et al. (2005). Cytoprotectieve effecten van nitriet tijdens in vivo ischemie-reperfusie van het hart en de lever. J Clin Invest 2005; 115 (5): 1232-1240. Opgehaald van ncbi.nlm.nih.gov.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.



Niemand heeft nog op dit artikel gereageerd.