
Bariumperoxide (BaO2) structuur, eigenschappen en toepassingen

De bariumperoxide is een ionische en anorganische verbinding waarvan de chemische formule BaO istwee. Omdat het een ionische verbinding is, bestaat het uit Ba-ionentwee+ metweetwee-dit laatste is wat bekend staat als het peroxide-anion, en daarom ook het BaOtwee krijgt zijn naam. Dit is het geval, de BaOtwee is een anorganisch peroxide.
De ladingen van zijn ionen laten zien hoe deze verbinding uit de elementen wordt gevormd. Het bariummetaal uit groep 2 geeft twee elektronen aan het zuurstofmolecuul, Otwee, waarvan de atomen niet worden gebruikt om zichzelf te reduceren tot oxide-anionen, ORtwee-, maar om bij elkaar te worden gehouden door een simpele link, [O-O]twee-.

Bariumperoxide is een korrelige vaste stof bij kamertemperatuur, wit van kleur met lichtgrijze tinten (bovenste afbeelding). Zoals bijna alle peroxiden, moet het met zorg worden gehanteerd en opgeslagen, omdat het de oxidatie van bepaalde stoffen kan versnellen.
Van alle peroxiden gevormd door metalen uit groep 2 (Mr. Becambara), BaOtwee het is thermodynamisch het meest stabiel tegen zijn thermische ontleding. Bij verhitting komt zuurstof vrij en wordt bariumoxide, BaO, geproduceerd. BaO kan onder hoge druk reageren met zuurstof in de omgeving om weer BaO te vormentwee.
Artikel index
- 1 Structuur
- 1.1 Kristalrooster-energie
- 1.2 Hydrateert
- 2 Bereiding of synthese
- 3 Eigenschappen
- 3.1 Fysiek uiterlijk
- 3.2 Molecuulmassa
- 3.3 Dichtheid
- 3.4 Smeltpunt
- 3.5 Kookpunt
- 3.6 Oplosbaarheid in water
- 3.7 Thermische ontleding
- 4 Nomenclatuur
- 5 toepassingen
- 5.1 Zuurstofproducent
- 5.2 Producent van waterstofperoxide
- 6 referenties
Structuur
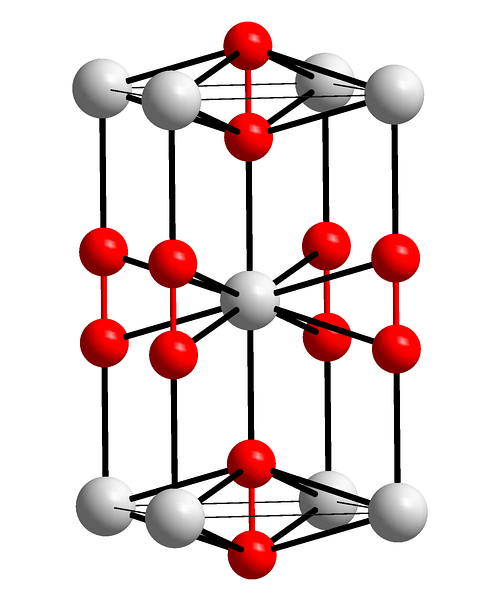
De bovenste afbeelding toont de tetragonale eenheidscel van bariumperoxide. Binnenin zijn de kationen Ba te zientwee+ (witte bollen), en de anionen Otweetwee- (rode bollen). Merk op dat de rode bollen zijn verbonden door een enkele binding, dus vertegenwoordigen ze lineaire geometrie [O-O]twee-.
Vanuit deze eenheidscel kunnen BaO-kristallen worden opgebouwdtwee. Indien waargenomen, het anion Otweetwee- het blijkt omringd te zijn door zes Batwee+, het verkrijgen van een octaëder waarvan de hoekpunten wit zijn.
Aan de andere kant, nog duidelijker, elke Batwee+ is omgeven door tien Otweetwee- (witte bol in het midden). Alle kristallen bestaan uit deze constante volgorde op korte en lange afstand.
Kristalrooster-energie
Als ook de rood-witte bollen worden waargenomen, zal worden opgemerkt dat ze niet te veel verschillen in hun grootte of ionische stralen. Dit komt doordat het Ba kationtwee+ is erg omvangrijk, en zijn interacties met het anion Otweetwee- stabiliseren de rooster-energie van het kristal in een betere mate in vergelijking met bijvoorbeeld Ca-kationentwee+ en Mgtwee+.
Dit verklaart ook waarom BaO de meest onstabiele van de aardalkalimetaaloxiden is: Ba-ionen.twee+ metwee- verschillen aanzienlijk in grootte, waardoor hun kristallen worden gedestabiliseerd.
Omdat het instabieler is, is de trend van BaO lagertwee ontleden om BaO te vormen; in tegenstelling tot peroxiden SrOtwee, CaOtwee en MgOtwee, waarvan de oxiden stabieler zijn.
Hydrateert
De BaOtwee komt voor in de vorm van hydraten, waarvan BaOtwee∙ 8HtweeOf het is de meest stabiele van allemaal; en in feite is dit degene die op de markt wordt gebracht, in plaats van het watervrije bariumperoxide. Om de watervrije te verkrijgen, moet de BaO worden gedroogd bij 350 ° Ctwee∙ 8HtweeOf om het water te verwijderen.
De kristalstructuur is ook tetragonaal, maar met acht moleculen van H.tweeO interactie met de Otweetwee- via waterstofbruggen, en met de Batwee+ door dipool-ion-interacties.
Andere hydraten, waarvan er in dit opzicht niet veel informatie is, zijn: BaOtwee∙ 10HtweeO, BaOtwee∙ 7HtweeO en BaOtwee∙ HtweeOF.
Bereiding of synthese
De directe bereiding van bariumperoxide bestaat uit de oxidatie van zijn oxide. Dit kan worden gebruikt uit het mineraal bariet, of uit het bariumnitraatzout, Ba (NO3tweebeide worden verwarmd in een met lucht of zuurstof verrijkte atmosfeer.
Een andere methode bestaat uit het laten reageren van Ba (NO3twee met natriumperoxide:
Bad3twee + NatweeOFtwee + xHtweeO => BaOtwee∙ xHtweeO + 2NaNO3
Vervolgens hydrateert BaOtwee∙ xHtweeOf het wordt verwarmd, gefilterd en afgewerkt door vacuüm te drogen.
Eigendommen
Fysiek uiterlijk
Het is een witte vaste stof die grijsachtig kan worden als deze onzuiverheden bevat (ofwel BaO, Ba (OH)twee, of andere chemische soorten). Als het wordt verwarmd tot een zeer hoge temperatuur, zal het groenachtige vlammen afgeven vanwege de elektronische overgangen van de Ba kationen.twee+.
Moleculaire massa
169,33 g / mol.
Dichtheid
5,68 g / ml.
Smeltpunt
450 ° C.
Kookpunt
800 ° C. Deze waarde komt overeen met wat verwacht mag worden van een ionische verbinding; en zelfs meer, van het meest stabiele aardalkalimetaalperoxide. De BaO kookt echter niet echttwee, in plaats daarvan komt gasvormige zuurstof vrij als gevolg van zijn thermische ontleding.
Oplosbaarheid in water
Onoplosbaar. Het kan echter langzaam hydrolyse ondergaan om waterstofperoxide te produceren, H.tweeOFtweeen verder neemt de oplosbaarheid ervan in waterig medium toe als een verdund zuur wordt toegevoegd.
Thermische ontleding
De volgende chemische vergelijking toont de thermische ontledingsreactie die BaO ondergaattwee
2BaOtwee <=> 2BaO + Otwee
De reactie is eenrichtingsverkeer als de temperatuur hoger is dan 800 ° C. Als de druk onmiddellijk wordt verhoogd en de temperatuur daalt, wordt al het BaO weer omgezet in BaOtwee.
Nomenclatuur
Een andere manier om de BaO te noementwee het is bariumperoxide, volgens de traditionele nomenclatuur; omdat barium alleen de valentie +2 kan hebben in zijn verbindingen.
Ten onrechte wordt de systematische nomenclatuur gebruikt om ernaar te verwijzen als bariumdioxide (binoxide), aangezien het een oxide is en geen peroxide.
Toepassingen
Zuurstofproducent
Met behulp van het mineraal bariet (BaO) wordt het verwarmd met luchtstromen om het zuurstofgehalte te verwijderen, tot een temperatuur van ongeveer 700 ° C..
Als het resulterende peroxide voorzichtig onder vacuüm wordt verwarmd, wordt de zuurstof sneller geregenereerd en kan het bariet voor onbepaalde tijd worden hergebruikt om zuurstof op te slaan en te produceren..
Dit proces werd commercieel bedacht door L. D. Brin, nu achterhaald.
Producent van waterstofperoxide
Bariumperoxide reageert met zwavelzuur om waterstofperoxide te produceren:
Straaltwee + H.tweeSW4 => HtweeOFtwee + Baso4
Het is dus een bron van H.tweeOFtwee, vooral gemanipuleerd met zijn hydraat BaOtwee∙ 8HtweeOF.
Volgens deze twee genoemde toepassingen is de BaOtwee maakt de ontwikkeling van Otwee en HtweeOFtwee, beide oxidatiemiddelen, bij organische synthese en bij bleekprocessen in de textiel- en kleurstofindustrie. Het is ook een goed ontsmettingsmiddel..
Bovendien, van BaOtwee andere peroxiden kunnen worden gesynthetiseerd, zoals natrium, NatweeOFtwee, en andere bariumzouten.
Referenties
- S.C. Abrahams, J Kalnajs. (1954). De kristalstructuur van bariumperoxide. Laboratorium voor isolatieonderzoek, Massachusetts Institute of Technology, Cambridge, Massachusetts, VS..
- Wikipedia. (2018). Bariumperoxide. Hersteld van: en.wikipedia.org
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Atomistry. (2012). Bariumperoxide. Hersteld van: barium.atomistry.com
- Khokhar et al. (2011). Studie van de voorbereiding en ontwikkeling van een proces voor bariumperoxide op laboratoriumschaal. Hersteld van: academia.edu
- PubChem. (2019). Bariumperoxide. Hersteld van: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Bereiding van bariumperoxide. Hersteld van: prepchem.com



Niemand heeft nog op dit artikel gereageerd.