
Polytropische proceseigenschappen, toepassingen en voorbeelden
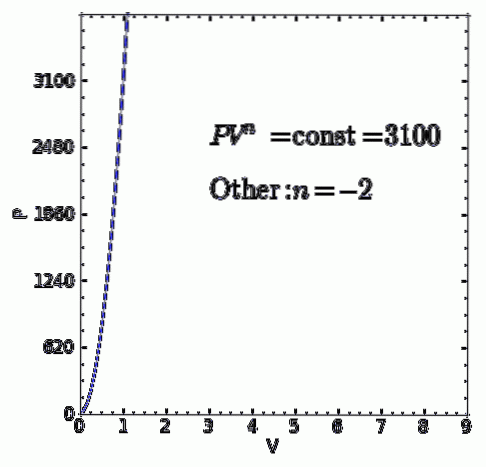
EEN polytropisch proces is een thermodynamisch proces dat optreedt wanneer de relatie tussen de druk P. en het volume V. gegeven door P.Vn het blijft constant. De exponent n is een reëel getal, meestal tussen nul en oneindig, maar in sommige gevallen kan het negatief zijn.
De waarde van n ontvangt de naam van polytropie-index en het is belangrijk om te benadrukken dat tijdens een polytropisch thermodynamisch proces genoemde index een vaste waarde moet behouden, anders wordt het proces niet als polytropisch beschouwd.

Artikel index
- 1 Kenmerken van polytropische processen
- 2 Toepassingen
- 2.1 Werk aan polytropische processen voor verschillende waarden van n
- 3 Voorbeelden van polytropische processen
- 3.1 - Voorbeeld 1
- 3.2 - Voorbeeld 2
- 4 referenties
Kenmerken van polytropische processen
Enkele kenmerkende gevallen van polytropische processen zijn:
- Het isotherme proces (bij constante temperatuur T), waarbij de exponent n = 1 is.
- Een isobaar proces (bij constante druk P), in dit geval n = 0.
- Het isochore proces (bij constant volume V), waarvoor n = + ∞.
- Adiabatische processen (bij constante S entropie), waarbij de exponent n = γ is, waarbij γ de adiabatische constante is. Deze constante is het quotiënt tussen de warmtecapaciteit bij constante druk Cp gedeeld door de warmtecapaciteit bij constant volume Cv:
γ = Cp / Cv
- Elk ander thermodynamisch proces dat niet een van de voorgaande gevallen is. maar dat voldoet P.Vn = ctte met echte en constante polytropische index n het zal ook een polytropisch proces zijn.
Toepassingen
Een van de belangrijkste toepassingen van de polytropische vergelijking is het berekenen van het werk dat wordt gedaan door een gesloten thermodynamisch systeem, wanneer het op een quasi-statische manier overgaat van een begintoestand naar een eindtoestand, dat wil zeggen na een opeenvolging van evenwichtstoestanden..
Werk aan polytropische processen voor verschillende waarden van n
Voor n ≠ 1
De mechanische arbeid W uitgevoerd door een gesloten thermodynamisch systeem wordt berekend door de uitdrukking:
W = ∫P.dV
Waar P is de druk en V het volume.
Net als bij een polytropisch proces is de relatie tussen druk en volume:
P.V n = constante = C
Oplossen voor P uit de vorige uitdrukking om deze in de werkuitdrukking te vervangen:
P = C /V. n
We laten het mechanische werk uitvoeren tijdens een polytropisch proces, dat begint in een begintoestand 1 en eindigt in de eindtoestand 2. Dit alles verschijnt in de volgende uitdrukking:


C = P1 V.1n = P.twee V.tween
Door de waarde van de constante in de werkuitdrukking te vervangen, krijgen we:
W = (Blztwee V.twee - P.1 V.1) / (1-n)
In het geval dat de werksubstantie kan worden gemodelleerd als een ideaal gas, hebben we de volgende toestandsvergelijking:
P.V = m.R.T
Waarbij m het aantal mol van het ideale gas is en R de universele gasconstante.
Voor een ideaal gas dat een polytropisch proces volgt met een polytropie-index die verschilt van eenheid en dat overgaat van een toestand met begintemperatuur T1 naar een andere staat met temperatuur Ttwee we hebben dat het uitgevoerde werk wordt gegeven door de volgende formule:
W = m R (Ttwee - T1) / (1-n)
Voor n → ∞
Volgens de formule voor het werk verkregen in de vorige sectie, hebben we dat het werk van een polytropisch proces met n = ∞ nul is, omdat de uitdrukking van het werk gedeeld is door oneindig en daarom neigt het resultaat naar nul.
Een andere manier om tot dit resultaat te komen, is vanuit de relatie P1 V.1n = P.twee V.tween, die als volgt kan worden herschreven:
(Blz1/ P.twee) = (V.twee/ V1)n
Als we de nde wortel in elk lid nemen, krijgen we:
(V.twee/ V1) = (P.1/ P.twee(1 / n)
In het geval dat n → ∞, hebben we (Vtwee/ V1) = 1, wat betekent dat:
V.twee = V1
Dat wil zeggen, het volume verandert niet in een polytropisch proces met n → ∞. Daarom is het volumeverschil dV in de integraal van mechanisch werk 0. Dit soort polytropische processen zijn ook bekend als processen isochoor, of processen met een constant volume.
Voor n = 1
Opnieuw hebben we de uitdrukking de uitdrukking voor werk:
W = ∫P dV
In het geval van een polytropisch proces met n = 1, is de relatie tussen druk en volume:
P V = constant = C
Door P uit de vorige uitdrukking op te lossen en te substitueren, hebben we het werk gedaan om van begintoestand 1 naar eindtoestand 2 te gaan:

Namelijk:
W = C ln (Vtwee/ V1.
Omdat de begin- en eindtoestand goed zijn bepaald, geldt dat ook voor de ctte. Namelijk:
C = P1 V.1 = P.twee V.twee
Ten slotte hebben we de volgende bruikbare uitdrukkingen om het mechanische werk te vinden van een polytropisch gesloten systeem waarin n = 1.
W = P1 V.1 ln (Vtwee/ V1) = P.twee V.twee ln (Vtwee/ V1
Als de werksubstantie bestaat uit m mol ideaal gas, dan kan de ideale gasstatusvergelijking worden toegepast: P V = m.R.T.
In dit geval, zoals P.V1 = ctte, we hebben dat een polytropisch proces met n = 1 een proces is bij constante temperatuur T (isotherm), zodat de volgende uitdrukkingen voor het werk kunnen worden verkregen:
W = m R T1 ln (Vtwee/ V1) = m R Ttwee ln (Vtwee/ V1

Voorbeelden van polytropische processen
- voorbeeld 1
Stel dat een cilinder met een beweegbare zuiger gevuld is met één kilogram lucht. Aanvankelijk neemt de lucht een volume V in1= 0,2 m3 bij een druk P1= 400 kPa. Een polytropisch proces wordt gevolgd met n = γ = 1,4, waarvan de eindtoestand druk P heefttwee = 100 kPa. Bepaal het werk dat wordt gedaan door de lucht op de zuiger.
Oplossing
Wanneer de polytropie-index gelijk is aan de adiabatische constante, is er een proces waarbij de werksubstantie (lucht) geen warmte uitwisselt met de omgeving, en daarom verandert de entropie niet..
Voor lucht, een diatomisch ideaal gas, hebben we:
γ = Cp / Cv, met Cp = (7/2) R en Cv = (5/2) R
Dan:
γ = 7/5 = 1,4
Met behulp van de uitdrukking van het polytropisch proces kan het uiteindelijke volume van de lucht worden bepaald:
V.twee = [(Blztwee V.11.4) / Blztwee(1 / 1.4) = 0,54 m3.
Nu hebben we de voorwaarden om de formule toe te passen voor werk gedaan in een polytropisch proces voor n ≠ 1 dat hierboven is verkregen:
W = (Blztwee V.twee - P1 V1) / (1-n)
Als we de juiste waarden vervangen, hebben we:
W = (100 kPa 0,54 m3 - 400 kPa 0,2 m3) / (1 - 1,4) = 65,4 kJ
- Voorbeeld 2
Veronderstel dezelfde cilinder uit Voorbeeld 1, met een beweegbare zuiger gevuld met één kilogram lucht. Aanvankelijk neemt de lucht een volume V1 = 0,2 m in3 bij een druk P1 = 400 kPa. Maar in tegenstelling tot het vorige geval, zet de lucht isotherm uit om een einddruk P2 = 100 kPa te bereiken. Bepaal het werk dat wordt gedaan door de lucht op de zuiger.
Oplossing
Zoals eerder gezien, zijn isotherme processen polytropische processen met index n = 1, dus het is waar dat:
P1 V1 = P2 V2
Op deze manier kan het uiteindelijke volume gemakkelijk worden afgepeld om:
V2 = 0,8 m3
Vervolgens, met behulp van de werkuitdrukking die eerder is verkregen voor het geval n = 1, hebben we dat het werk dat wordt gedaan door de lucht op de zuiger in dit proces is:
W = P1 V1 ln (V2 / V1) = 400000 Pa × 0,2 m3 ln (0,8 / 0,2) = 110,9 kJ.
Referenties
- Bauer, W. 2011. Physics for Engineering and Sciences. Deel 1. Mc Graw Hill.
- Cengel, Y. 2012. Thermodynamica. 7e editie. Mcgraw heuvel.
- Figueroa, D. (2005). Serie: Physics for Science and Engineering. Deel 4. Vloeistoffen en thermodynamica. Bewerkt door Douglas Figueroa (USB).
- López, C. De eerste wet van de thermodynamica. Hersteld van: culturacientifica.com.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9e Ed. Cengage Learning.
- Sevilla Universiteit. Thermische machines. Hersteld van: laplace.us.es.
- Wikiwand. Polytropisch proces. Hersteld van: wikiwand.com.
Niemand heeft nog op dit artikel gereageerd.