
Colligatieve eigenschappen (met formules)
De colligatieve eigenschap is een eigenschap van een stof die afhankelijk is van, of varieert naargelang het aantal deeltjes dat erin aanwezig is (in de vorm van moleculen of atomen), zonder afhankelijk te zijn van de aard van die deeltjes.
Met andere woorden, deze kunnen ook worden verklaard als eigenschappen van oplossingen die afhankelijk zijn van de relatie tussen het aantal opgeloste deeltjes en het aantal oplosmiddeldeeltjes. Dit concept werd in 1891 geïntroduceerd door de Duitse chemicus Wilhelm Ostwald, die de eigenschappen van opgeloste stof in drie categorieën onderverdeelde.

Deze categorieën verklaarden dat colligatieve eigenschappen uitsluitend afhingen van de concentratie en temperatuur van de opgeloste stof en niet van de aard van de deeltjes..
Bovendien hingen additieve eigenschappen zoals massa af van de samenstelling van de opgeloste stof, en waren constitutionele eigenschappen meer afhankelijk van de moleculaire structuur van de opgeloste stof..
Artikel index
- 1 Colligatieve eigenschappen
- 1.1 Verlaging van de dampspanning
- 1.2 Verhogen van de kooktemperatuur
- 1.3 Verlagen van de vriestemperatuur
- 1.4 Osmotische druk
- 2 referenties
Colligatieve eigenschappen
De colligatieve eigenschappen worden voornamelijk bestudeerd voor verdunde oplossingen (vanwege hun bijna ideale gedrag), en zijn als volgt:
Verlaging van de dampspanning
Men kan zeggen dat de dampdruk van een vloeistof de evenwichtsdruk is van de dampmoleculen waarmee die vloeistof in contact is.
Evenzo wordt de relatie tussen deze drukken verklaard met de wet van Raoult, die aangeeft dat de partiële druk van een component gelijk is aan het product van de molfractie van de component door de dampspanning van de component in zijn zuivere staat:
P.NAAR = XNAAR . PºNAAR
In deze uitdrukking:
P.NAAR = Gedeeltelijke dampspanning van component A in het mengsel.
XNAAR = Molfractie van component A.
PºNAAR= Dampspanning van zuivere component A.
In het geval van de afname van de dampspanning van een oplosmiddel, gebeurt dit wanneer een niet-vluchtige opgeloste stof eraan wordt toegevoegd om een oplossing te vormen. Zoals bekend en per definitie heeft een niet-vluchtige stof niet de neiging om te verdampen.
Om deze reden geldt dat hoe meer van deze opgeloste stof aan het vluchtige oplosmiddel wordt toegevoegd, hoe lager de dampspanning zal zijn en hoe minder oplosmiddel kan ontsnappen om een gasvormige toestand te worden..
Dus wanneer het oplosmiddel op natuurlijke wijze of met geweld verdampt, zal er uiteindelijk een hoeveelheid oplosmiddel achterblijven zonder te verdampen samen met de niet-vluchtige opgeloste stof..
Dit fenomeen is beter te verklaren met het concept van entropie: wanneer de moleculen een overgang maken van de vloeistoffase naar de gasfase, neemt de entropie van het systeem toe..
Dit betekent dat de entropie van deze gasfase altijd groter zal zijn dan die van de vloeibare toestand, omdat de gasmoleculen een groter volume innemen..
Als vervolgens de entropie van de vloeibare toestand toeneemt door verdunning, ook al is deze gekoppeld aan een opgeloste stof, neemt het verschil tussen de twee systemen af. Om deze reden verlaagt de afname in entropie ook de dampspanning..
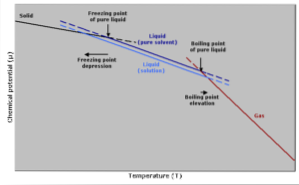
Kooktemperatuurstijging
Het kookpunt is die temperatuur waarbij er evenwicht is tussen de vloeistof- en gasfase. Op dit punt is het aantal gasmoleculen dat vloeibaar wordt (condenserend) gelijk aan het aantal vloeistofmoleculen dat verdampt tot gas..
De toevoeging van een opgeloste stof zorgt ervoor dat de concentratie van vloeibare moleculen verdunt, waardoor de verdampingssnelheid afneemt. Dit genereert een verandering in het kookpunt om de verandering in oplosmiddelconcentratie te compenseren..
Met andere eenvoudigere woorden, de kooktemperatuur van een oplossing is hoger dan die van het oplosmiddel in zuivere staat. Dit wordt uitgedrukt door een wiskundige uitdrukking die hieronder wordt weergegeven:
ATb = ik. Kb . m
In deze uitdrukking:
ATb = Tb (oplossing) - Tb (oplosmiddel) = variatie van kooktemperatuur.
i = van't Hoff-factor.
Kb = Kookconstante van het oplosmiddel (0,512 ºC / mol voor water).
m = Molaliteit (mol / kg).
Verlaging van de vriestemperatuur
De vriestemperatuur van een puur oplosmiddel zal afnemen wanneer een hoeveelheid opgeloste stof wordt toegevoegd, aangezien dit wordt beïnvloed door hetzelfde fenomeen dat de dampspanning afneemt..
Dit gebeurt omdat, door de dampspanning van het oplosmiddel te verlagen door een opgeloste stof te verdunnen, een lagere temperatuur nodig zal zijn om het te laten bevriezen..
De aard van het vriesproces kan ook in aanmerking worden genomen om dit fenomeen te verklaren: om een vloeistof te bevriezen, moet deze een geordende toestand bereiken waarin het uiteindelijk kristallen vormt..
Als er onzuiverheden in de vloeistof zitten in de vorm van opgeloste stoffen, zal de vloeistof minder geordend zijn. Om deze reden zal de oplossing grotere moeilijkheden hebben om te bevriezen dan een oplosmiddel zonder onzuiverheden..
Deze vermindering wordt uitgedrukt als:
ATF. = -i. KF. . m
In de bovenstaande uitdrukking:
ATF. = TF. (oplossing) - TF. (oplosmiddel) = Vriestemperatuurvariatie.
i = van't Hoff-factor.
KF. = Vriesconstante van het oplosmiddel (1,86 ºC kg / mol voor water).
m = Molaliteit (mol / kg).
Osmotische druk
Het proces dat bekend staat als osmose is de neiging van een oplosmiddel om door een semi-permeabel membraan te gaan van de ene oplossing naar de andere (of van een puur oplosmiddel naar een oplossing).
Dit membraan vormt een barrière waar sommige stoffen doorheen kunnen en andere niet, zoals in het geval van semipermeabele membranen in de celwanden van dieren- en plantencellen..
De osmotische druk wordt dan gedefinieerd als de minimale druk die op een oplossing moet worden uitgeoefend om de passage van het zuivere oplosmiddel door een semi-permeabel membraan te stoppen..
Het is ook bekend als de maat voor de neiging van een oplossing om het zuivere oplosmiddel te ontvangen vanwege het effect van osmose. Deze eigenschap is colligatief omdat deze afhangt van de concentratie opgeloste stof in de oplossing, die wordt uitgedrukt als een wiskundige uitdrukking:
Π. V = n. R. T, of ook π = M. R. T
In deze uitdrukkingen:
n = aantal mol deeltjes in de oplossing.
R = universele gasconstante (8,314472 J. K-1 . mol-1.
T = temperatuur in Kelvin.
M = molariteit.
Referenties
- Wikipedia. (s.f.). Colligatieve eigenschappen. Opgehaald van en.wikipedia.org
- BC. (s.f.). Colligatieve eigenschappen. Hersteld van opentextbc.ca
- Bosma, W. B. (s.f.). Colligatieve eigenschappen. Opgehaald van chemistryexplained.com
- Sparknotes. (s.f.). Colligatieve eigenschappen. Opgehaald van sparknotes.com
- Universiteit, F. S. (s.f.). Colligatieve eigenschappen. Opgehaald van chem.fsu.edu



Niemand heeft nog op dit artikel gereageerd.