
Wat is molaliteit? (met voorbeelden)
De molaliteit, aangegeven door de kleine letter m, het is een term die wordt gebruikt om de concentratie van een oplossing te beschrijven. Het kan worden gedefinieerd als het aantal mol opgeloste stof in 1 kilogram oplosmiddel.
Het is gelijk aan het aantal mol opgeloste stof (de stof die oplost) gedeeld door het aantal kilogram oplosmiddel (de stof die wordt gebruikt om op te lossen).
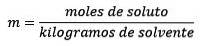
Waar de molen opgeloste stof worden gegeven door de vergelijking:
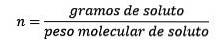
Dus uiteindelijk is de molaliteitsvergelijking

Artikel index
- 1 Kenmerken van molaliteit
- 2 Verschillen en overeenkomsten tussen molaliteit (m) en molariteit (M)
- 3 Voorbeelden van molaliteit
- 3.1 Voorbeeld 1:
- 3.2 Voorbeeld 2:
- 3.3 Voorbeeld 3:
- 4 referenties
Kenmerken van molaliteit
Molaliteit is een maat voor de concentratie van een opgeloste stof in een oplossing. Wordt voornamelijk gebruikt als de temperatuur een probleem is.

Molaliteit is niet zo gebruikelijk als zijn tegenhanger, molariteit (mol opgeloste stof per liter oplosmiddel), maar het wordt gebruikt in zeer specifieke berekeningen, vooral met betrekking tot colligatieve eigenschappen (kookpuntverhoging, kookpuntverlaging). Van bevriezing).
Omdat het volume onderhevig is aan variatie als gevolg van temperatuur en druk, varieert de molariteit ook afhankelijk van temperatuur en druk. In sommige gevallen is het gebruik van gewicht een voordeel omdat de massa niet varieert met de omgevingsomstandigheden..
Het is belangrijk dat de massa van het oplosmiddel wordt gebruikt en niet de massa van de oplossing. Oplossingen die zijn gelabeld met molaire concentratie, worden aangegeven met een kleine letter m. Een oplossing van 1,0 m bevat 1 mol opgeloste stof per kilogram oplosmiddel.
De bereiding van een oplossing met een bepaalde molaliteit is eenvoudig omdat er alleen een goede schaal voor nodig is. Zowel het oplosmiddel als de opgeloste stof worden gemengd, in plaats van gemeten naar volume.
De SI (International System) -eenheid voor molaliteit is mol / kg, of mol opgeloste stof per kg oplosmiddel. Een oplossing met een molaliteit van 1 mol / kg wordt vaak omschreven als "1 mol" of "1 m".
Volgens het SI-eenheidssysteem beschouwt het National Institute of Standards and Technology, de Amerikaanse autoriteit op het gebied van meten, de term 'molal' en het eenheidssymbool 'm' echter als verouderd en stelt voor om mol / kg te gebruiken..
Verschillen en overeenkomsten tussen molaliteit (m) en molariteit (M)
De bereiding van een oplossing met een bepaalde molaliteit omvat het wegen van zowel de opgeloste stof als het oplosmiddel en het verkrijgen van hun massa..
Maar in het geval van molariteit wordt het volume van de oplossing gemeten, wat ruimte laat voor variaties in de dichtheid als gevolg van de omgevingscondities van temperatuur en druk..
Dit betekent dat het voordelig is om te werken met de molaliteit die met de massa te maken heeft, omdat in de chemische samenstelling de massa van een bekende zuivere stof belangrijker is dan het volume, aangezien de volumes kunnen worden gewijzigd onder invloed van temperatuur en druk terwijl de massa blijft ongewijzigd.
Bovendien vinden chemische reacties plaats in verhouding tot massa, niet in volume. Om te worden gebaseerd op massa, kan molaliteit gemakkelijk worden omgezet in een massaverhouding of een massafractie.
Voor waterige oplossingen (oplossingen waarin water het oplosmiddel is) nabij kamertemperatuur, is het verschil tussen molaire en molaire oplossingen verwaarloosbaar..
Dit komt omdat rond kamertemperatuur water een dichtheid heeft van 1 kg / L. Dit betekent dat de "per L" molariteit gelijk is aan de "per kg" molaliteit..
Voor een oplosmiddel zoals ethanol, waar de dichtheid 0,789 kg / l is, zou een 1 M-oplossing 0,789 m zijn.
Het belangrijkste onderdeel van het onthouden van het verschil is:
Molariteit - M → mol per liter oplossing.
Molaliteit - m → mol per kilogram oplosmiddel.
Voorbeelden van molaliteit
Voorbeeld 1:
Probleem: Wat is de molaliteit van een oplossing met 0,086 mol NaCl opgelost in 25,0 g water??
Antwoord: In dit voorbeeld wordt de directe molaliteitsvergelijking gebruikt:
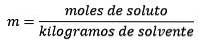
Mol opgeloste stof (NaCl) = 0,086 mol
Massa (water) = 25,0 g = 25,0 x 10-3 kg
Vervanging hebben we:
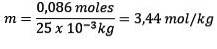
Voorbeeld 2:
Probleem: Wat is de molaliteit van een oplossing als 124,2 gram NaOH wordt opgelost in 1,00 liter water? (De dichtheid van water is gelijk aan 1,00 g / ml).
Antwoord: Water staat bekend als het universele oplosmiddel en de dichtheid wordt meestal gegeven als 1,00 gram per milliliter, of wat hetzelfde is als 1 kilogram per liter. Hierdoor is het eenvoudig om te rekenen van liters naar kilogrammen..
Bij deze opgave zal de 124,2 gram NaOH moeten worden omgezet in molen (voor molen opgeloste stof) en zal één liter water moeten worden omgezet in kilogrammen (per kilogram oplosmiddel) met behulp van de dichtheid.
Zoek eerst de molaire massa van NaOH:
P.MNa= 22,99 g / mol
P.MOF= 16 g / mol
P.MH.= 1 g / mol
P.MNaOH= 22,99 g / mol +16 g / mol +1 g / mol = 39,99 g / mol
Ten tweede zet je de grammen NaOH om in mol, met behulp van de molaire massa:
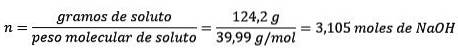
Ten derde, zet de liter water om in kilogram met behulp van de dichtheid.
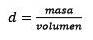
Oplossen voor de massa blijft
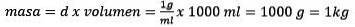
Eindelijk is de molaliteitsvergelijking opgelost:
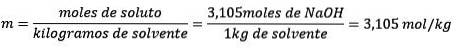
Voorbeeld 3:
Probleem: Wat is de massa water van een waterige oplossing die 0,52 gram bariumchloride (BaCltwee, PM = 208,23 g / mol) waarvan de concentratie 0,005 mol / kg is?
Antwoord: in dit geval wordt de molaire concentratie gebruikt om de hoeveelheid water in oplossing te bepalen.
Eerst wordt het aantal mol BaCl verkregentwee in de oplossing:
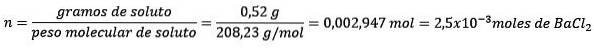
Ten tweede, verwijder kilogram oplosmiddel uit de molaliteitsvergelijking en los het op.
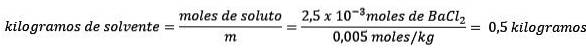
Referenties
- Wetenschappelijke notities en projecten. (2015, 22 februari). Voorbeeldprobleem van molaliteit berekenen. Opgehaald van sciencenotes.org.
- Bhardwaj, M. (2014, 26 november). Wat is een voorbeeld van molaliteit? Opgehaald van socratic.org.
- (S.F.). Molaliteit. Hersteld van boundless.com.
- Helmenstine, T. (2017, 19 februari). Wat is het verschil tussen molariteit en molaliteit? Opgehaald van thoughtco.com.
- Molality Formula. (S.F.). Opgehaald van softschools.com.
- Molaliteit. (S.F.). Opgehaald van chemteam.l
- Wat is molaliteit? (S.F.). Hersteld van freechemistryonline.com.


Niemand heeft nog op dit artikel gereageerd.