
Quaternaire verbindingen kenmerken, vorming, voorbeelden
De quaternaire verbindingen Ze hebben allemaal vier verschillende atomen of ionen. Daarom kunnen ze moleculaire of ionische soorten zijn. Hun diversiteit omvat zowel organische als anorganische chemie, aangezien het een zeer omvangrijke groep is; hoewel misschien niet zozeer vergeleken met binaire of ternaire verbindingen.
De reden dat hun aantal kleiner is, is omdat de vier atomen of ionen bij elkaar moeten worden gehouden door hun chemische affiniteiten. Niet alle elementen zijn compatibel met elkaar, en al helemaal niet wanneer een kwartet in overweging wordt genomen; plotseling een paar van hen zijn meer verwant aan elkaar dan aan het andere paar.
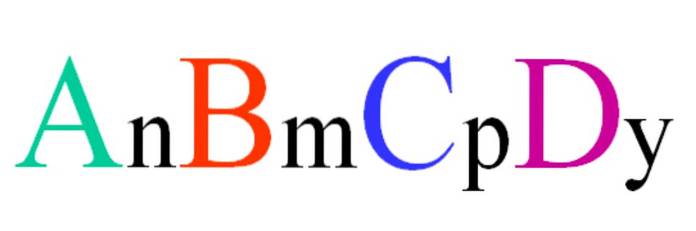
Beschouw een quaternaire verbinding met de willekeurige formule ABCD. De subscripts n, m, p en y zijn de stoichiometrische coëfficiënten, die op hun beurt aangeven welk aandeel van elk atoom er is in verhouding tot de andere..
Dus de formule AnBmCpDY het is geldig als het voldoet aan elektroneutraliteit. Bovendien is een dergelijke verbinding mogelijk als de vier atomen voldoende aan elkaar zijn gerelateerd. Het zal duidelijk zijn dat deze formule niet op veel verbindingen van toepassing is, maar vooral op legeringen of mineralen..
Artikel index
- 1 Kenmerken van quaternaire verbindingen
- 1.1 Chemie
- 1.2 Fysiek
- 2 Nomenclatuur
- 2.1 Zure oxisales
- 2.2 Basische oxisales
- 2.3 Dubbele zouten
- 2.4 Gehydrateerde zouten
- 3 Opleiding
- 4 voorbeelden
- 5 referenties
Kenmerken van quaternaire verbindingen
Chemisch
Een quaternaire verbinding kan ionisch of covalent zijn en de karakteristieken vertonen die voor zijn aard worden verwacht. Van ionische ABCD-verbindingen wordt verwacht dat ze oplosbaar zijn in water, alcoholen of andere polaire oplosmiddelen; ze moeten een hoog kook- en smeltpunt hebben en goede elektriciteitsgeleiders zijn als ze gesmolten zijn.
Wat betreft de covalente ABCD-verbindingen, de meeste bestaan uit stikstofhoudende, geoxygeneerde of gehalogeneerde organische verbindingen; dat wil zeggen, de formule zou C wordennH.mOFpNY of CnH.mOFpXY, waarbij X een halogeenatoom is. Van deze moleculen zou het logisch zijn om te denken dat ze polair waren, gezien de hoge elektronegativiteiten van O, N en X.
Een puur covalente ABCD-verbinding kan vele bindingsmogelijkheden hebben: A-B, B-C, D-A, enz., Uiteraard afhankelijk van de affiniteiten en elektronische capaciteiten van de atomen. Terwijl in een puur ionische ABCD-verbinding de interacties elektrostatisch zijn: A.+B-C+D-, bijvoorbeeld.
In het geval van een legering, die eigenlijk meer als een vast mengsel dan als een verbinding wordt beschouwd, bestaat ABCD uit neutrale atomen in grondtoestanden (in theorie).
Van de rest kan een ABCD-verbinding neutraal, zuur of basisch zijn, afhankelijk van de identiteit van zijn atomen..
Fysiek
Fysiek gezien is het waarschijnlijk dat ABCD geen gas zal worden, aangezien vier verschillende atomen altijd een hogere moleculaire massa of formule impliceren. Als het geen vloeistof met een hoog kookpunt is, is het te verwachten dat het een vaste stof is, waarvan de ontleding veel producten moet genereren.
Nogmaals, hun kleuren, geur, textuur, kristallen, enz., Zullen afhankelijk zijn van hoe A, B, C en D naast elkaar bestaan in de verbinding, en zullen afhangen van hun synergie en structuren..
Nomenclatuur
Tot dusver is de kwestie van quaternaire verbindingen globaal en onnauwkeurig benaderd. Afgezien van organische chemie (amiden, benzylchloriden, quaternaire ammoniumzouten, enz.), Zijn er in de anorganische chemie goed gedefinieerde voorbeelden die zure en basische oxysouten worden genoemd..
Zure oxisales
Zure oxyszouten zijn die afkomstig van de gedeeltelijke neutralisatie van een polyprotisch oxozuur. Dus een of meer van zijn waterstofatomen worden vervangen door metaalkationen, en hoe minder waterstofatomen er over zijn, hoe minder zuur het zal zijn..
Bijvoorbeeld uit fosforzuur, H3PO4, Er kunnen maximaal twee zure zouten van bijvoorbeeld natrium worden verkregen. Dit zijn: NaHtweePO4 (Na+ vervangt een waterstofequivalent aan H+) en NatweeHPO4.
Volgens de traditionele nomenclatuur worden deze zouten op dezelfde manier genoemd als oxyszouten (volledig gedeprotoneerd), maar met het woord 'zuur' voor de naam van het metaal. Dus de NaHtweePO4 zou natriumdizuurfosfaat en Na zijntweeHPO4 natriumzuurfosfaat (omdat er nog één H over is).
Aan de andere kant gebruikt de voorraadnomenclatuur liever het woord 'waterstof' dan 'zuur'. De NaHtweePO4 zou dan natriumdiwaterstoffosfaat en Na wordentweeHPO4 natriumwaterstoffosfaat. Merk op dat deze zouten vier atomen hebben: Na, H, P en O.
Basis oxisales
De basische oxyszouten zijn die die het OH-anion in hun samenstelling bevatten-. Beschouw bijvoorbeeld het zout CaNO3OH (Ca.twee+ NIET3- Oh-Om het een naam te geven, zou het voldoende zijn om het woord 'basic' vooraf te laten gaan aan de naam van het metaal. De naam zou dus zijn: basisch calciumnitraat. En hoe zit het met de CuIO3OH? De naam zou zijn: cupric basic jodate (Cutwee+ IO3- Oh-.
Volgens de voorraadnomenclatuur wordt het woord 'basis' vervangen door hydroxide, gevolgd door het gebruik van een koppelteken voor de naam van het oxoanion.
Als we de voorgaande voorbeelden herhalen, zouden hun namen voor elk zijn: calciumhydroxide-nitraat en koper (II) hydroxide-jodaat; Onthoud dat de valentie van het metaal tussen haakjes en met Romeinse cijfers moet worden aangegeven.
Dubbele zouten
In dubbelzouten zijn er twee verschillende kationen die in wisselwerking staan met hetzelfde type anion. Veronderstel dubbelzout: Cu3Geloof (PO43 (Cutwee+ Geloof3+ PO43-Het is een fosfaat van ijzer en koper, maar de meest toepasselijke naam om hier naar te verwijzen is: drievoudig fosfaat van koper (II) en ijzer (III).
Gehydrateerde zouten
Dit zijn hydraten en het enige verschil is dat het aantal te formuleren water aan het einde van hun naam wordt vermeld. Bijvoorbeeld de MnCltwee is mangaan (II) chloride.
Het hydrateert, MnCltwee4HtweeOf het wordt mangaan (II) chloride-tetrahydraat genoemd. Merk op dat er vier verschillende atomen zijn: Mn, Cl, H en O.
Een beroemd dubbel gehydrateerd zout is Mohr's, Fe (NH4twee(ZW4twee6HtweeO. Zijn naam is: dubbel ijzer (II) sulfaat en ammoniumhexahydraat.
Opleiding
Nogmaals, met de nadruk op anorganische quaternaire verbindingen, blijkt dat ze meestal het product zijn van gedeeltelijke neutralisaties. Als deze zich voordoen in de aanwezigheid van meerdere metaaloxiden, zullen er waarschijnlijk dubbelzouten ontstaan; en als het medium erg basisch is, zullen de basische oxyszouten neerslaan.
En als, aan de andere kant, de watermoleculen affiniteit hebben met het metaal, zullen ze er direct mee coördineren of met de ionen eromheen, en de hydraten vormen.
Aan de legeringszijde moeten vier verschillende metalen of metalloïden worden gelast om condensatoren, halfgeleiders of transistors te maken..
Voorbeelden
Ten slotte wordt hieronder een lijst met verschillende voorbeelden van quaternaire verbindingen weergegeven. De lezer kan het gebruiken om zijn kennis van de nomenclatuur te testen:
- PbCO3(OH)twee
- Cr (HSO43
- NaHCO3
- ZnIOH
- Cutwee(OH)tweeSW3
- LitweeKAsO4
- CURSUS45HtweeOF
- AgAu (ZO4twee
- Geval42HtweeOF
- FeCl36HtweeOF
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Nomenclatuur en anorganische formulering. [Pdf]. Hersteld van: recursostic.educacion.es
- Erika Thalîa Goed. (2019). Dubbele zouten. Academie. Hersteld van: academia.edu
- Wikipedia. (2019). Quaternair ammoniumkation. Hersteld van: en.wikipedia.org


Niemand heeft nog op dit artikel gereageerd.