
Wat is een verzadigde oplossing? (met voorbeelden)

EEN verzadigde oplossing Het is een chemische oplossing die de maximale concentratie opgeloste stof in een oplosmiddel bevat. Het wordt beschouwd als een toestand van dynamisch evenwicht waarin de snelheden waarmee het oplosmiddel de opgeloste stof oplost en de herkristallisatiesnelheid gelijk zijn (J., 2014).
De extra opgeloste stof lost niet op in een verzadigde oplossing en verschijnt in een andere fase, ofwel een neerslag als het een vaste stof in een vloeistof is, of een bruisen als het een gas in een vloeistof is (Anne Marie Helmenstine, 2016).
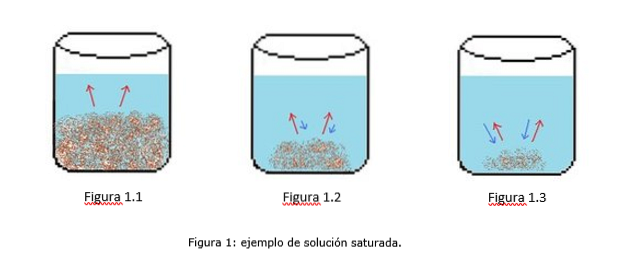
Een voorbeeld van een verzadigde oplossing wordt geïllustreerd in figuur 1. In de figuren 1.1, 1.2 en 1.3 is er een constant volume water in de beker. In figuur 1.1 begint het verzadigingsproces, waarbij de opgeloste stof begint op te lossen, weergegeven door de rode pijlen.
In figuur 1.2 is veel van de vaste stof opgelost, maar niet volledig als gevolg van het herkristallisatieproces, weergegeven door de blauwe pijlen..
In figuur 1.3 blijft slechts een kleine hoeveelheid opgeloste stof onopgelost. In dit geval is de herkristallisatiesnelheid groter dan de oplossnelheid. (puntjes van verzadiging, 2014)
Het punt van maximale concentratie van een opgeloste stof in een oplosmiddel staat bekend als het verzadigingspunt.
Artikel index
- 1 Factoren die de verzadiging beïnvloeden
- 1.1 Temperatuur
- 1.2 Druk
- 1.3 Chemische samenstelling
- 1.4 Mechanische factoren
- 2 Verzadigings- en oplosbaarheidscurves
- 3 Voorbeelden van verzadigde oplossingen
- 4 Wat is een oververzadigde oplossing?
- 5 referenties
Factoren die de verzadiging beïnvloeden
De hoeveelheid opgeloste stof die in een oplosmiddel kan worden opgelost, is afhankelijk van verschillende factoren, waarvan de belangrijkste zijn:
Temperatuur
Oplosbaarheid neemt toe met temperatuur. In heet water kan bijvoorbeeld meer zout worden opgelost dan in koud water..
Er kunnen echter uitzonderingen zijn, bijvoorbeeld de oplosbaarheid van gassen in water neemt af met toenemende temperatuur. In dit geval ontvangen de opgeloste moleculen kinetische energie terwijl ze opwarmen, wat hun ontsnapping vergemakkelijkt..
Druk
Verhoogde druk kan het oplossen van opgeloste stoffen forceren. Dit wordt vaak gebruikt om gassen in vloeistoffen op te lossen..
Chemische samenstelling
De aard van de opgeloste stof en het oplosmiddel en de aanwezigheid van andere chemische verbindingen in de oplossing beïnvloeden de oplosbaarheid. In water kan bijvoorbeeld meer suiker worden opgelost dan zout in water. In dit geval wordt gezegd dat suiker beter oplosbaar is.
Ethanol in water zijn volledig met elkaar oplosbaar. In dit specifieke geval is het oplosmiddel de verbinding die in de grootste hoeveelheid wordt aangetroffen.
Mechanische factoren
In tegenstelling tot de oplossnelheid, die voornamelijk afhangt van de temperatuur, hangt de herkristallisatiesnelheid af van de opgeloste stofconcentratie op het oppervlak van het kristalrooster, wat de voorkeur heeft wanneer een oplossing onbeweeglijk is.
Daarom, roeren van de oplossing vermijdt deze accumulatie, waardoor de ontbinding wordt gemaximaliseerd (tipes of saturation, 2014).
Verzadiging en oplosbaarheidscurves
De oplosbaarheidscurves zijn een grafische database waarin de hoeveelheid opgeloste stof die oplost in een hoeveelheid oplosmiddel wordt vergeleken, bij een bepaalde temperatuur.
Oplosbaarheidscurves worden gewoonlijk uitgezet voor een hoeveelheid opgeloste stof, hetzij vast of gas, in 100 gram water (Brian, 2014).
Figuur 2 illustreert de verzadigingskrommen voor verschillende opgeloste stoffen in water..
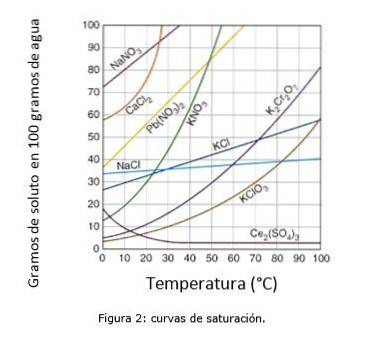
Op de as van de coördinaten hebben we de temperatuur in graden Celsius, en op de as van de abscis hebben we de concentratie opgeloste stof uitgedrukt in gram opgeloste stof per 100 gram water.
De curve geeft het verzadigingspunt aan bij een bepaalde temperatuur. Het gebied onder de curve geeft aan dat u een onverzadigde oplossing heeft en dat er daarom meer opgeloste stof kan worden toegevoegd..
Het gebied boven de curve heeft een oververzadigde oplossing. (Oplosbaarheidscurves, n.d.)
Als we natriumchloride (NaCl) als voorbeeld nemen, kan bij 25 graden Celsius ongeveer 35 gram NaCl worden opgelost in 100 gram water om een verzadigde oplossing te verkrijgen. (Cambrige University, s.f.)
Voorbeelden van verzadigde oplossingen
Verzadigde oplossingen zijn dagelijks te vinden, het is niet nodig om in een chemisch laboratorium te zijn. Het oplosmiddel hoeft niet per se water te zijn. Hieronder staan alledaagse voorbeelden van verzadigde oplossingen:
-Frisdrank en frisdranken zijn over het algemeen verzadigde oplossingen van kooldioxide in water. Dat is de reden waarom, wanneer de druk wordt opgeheven, bellen van kooldioxide worden gevormd..
-Aardbodems zijn verzadigd met stikstof.
-Suiker of zout kan aan de azijn worden toegevoegd om een verzadigde oplossing te vormen..
-Voeg chocoladepoeder toe aan melk totdat het niet oplost, het vormt een verzadigde oplossing.
-Melk kan zodanig met bloem worden verzadigd dat er geen bloem meer aan de melk kan worden toegevoegd.
-Gesmolten boter kan worden verzadigd met zout, wanneer het zout niet meer oplost.
Wat is een oververzadigde oplossing?
De definitie van een oververzadigde oplossing is er een die meer opgeloste stof bevat dan normaal zou kunnen worden opgelost in het oplosmiddel. Dit wordt meestal gedaan door de temperatuur van de oplossing te verhogen..
Een kleine wijziging van de oplossing of introductie van een "kiem" of een klein kristal van opgeloste stof zal kristallisatie van de overtollige opgeloste stof afdwingen. Als er geen kiemvormingspunt is voor kristalvorming, kan overtollige opgeloste stof in oplossing blijven.
Een andere vorm van oververzadiging kan optreden wanneer een verzadigde oplossing zorgvuldig wordt gekoeld. Deze verandering in omstandigheden betekent dat de concentratie eigenlijk hoger is dan het verzadigingspunt, de oplossing is oververzadigd..
Dit kan worden gebruikt in het herkristallisatieproces om een chemische stof te zuiveren: het lost op tot het verzadigingspunt in heet oplosmiddel, en als het oplosmiddel afkoelt en de oplosbaarheid afneemt, slaat een overmaat aan opgeloste stof neer.
Onzuiverheden, die in een veel lagere concentratie aanwezig zijn, verzadigen het oplosmiddel niet en blijven dus opgelost in de vloeistof.
Referenties
- Anne Marie Helmenstine, P. (2016, 7 juli). Verzadigde oplossingsdefinitie en voorbeelden. Opgehaald van about: about.com
- Cambrige Universiteit. (s.f.). Oplosbaarheidscurves. Opgehaald van dynamicscience.com: dynamicscience.com.au.
- Voorbeelden van verzadigde oplossingen. (s.f.). Opgehaald van yourdcitionary: voorbeelden.yourdictionary.com.
- , S. (2014, 4 juni). Verzadigde en oververzadigde oplossingen. Opgehaald van socratic.org: socratic.org.
- James, N. (s.f.). Verzadigde oplossing: definitie en voorbeelden. Opgehaald van study.com: study.com.
- , B. (2014, 14 oktober). Verzadigde en oververzadigde oplossingen. Opgehaald van socratic.org: socratic.org.
- Oplosbaarheidscurves. (s.f.). Opgehaald van KentChemistry: kentchemistry.com.
- Tipes van verzadiging. (2014, 26 juni). Opgehaald uit chemie libretex: chem.libretexts.org.


Niemand heeft nog op dit artikel gereageerd.