
Wat zijn dipool-dipoolkrachten?
De dipool-dipoolkrachten of Keesom-krachten zijn die intermoleculaire interacties die aanwezig zijn in moleculen met permanente dipoolmomenten. Het is een van de Van der Waals-krachten en hoewel het verre van de sterkste is, is het een sleutelfactor die de fysische eigenschappen van veel verbindingen verklaart..
De term "dipool" verwijst expliciet naar twee polen: een negatief en een positief. We spreken dus van dipolaire moleculen wanneer ze gebieden met hoge en lage elektronendichtheden hebben gedefinieerd, wat alleen mogelijk is als de elektronen bij voorkeur "migreren" naar bepaalde atomen: de meest elektronegatieve..
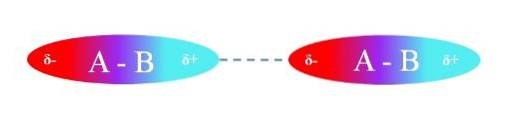
De bovenste afbeelding illustreert de dipool-dipool-interacties tussen twee A-B-moleculen met permanente dipoolmomenten. Evenzo kan worden waargenomen hoe de moleculen zijn georiënteerd, zodat de interacties efficiënt zijn. Het positieve gebied δ + trekt dus het negatieve gebied δ aan-.
Volgens het bovenstaande kan worden gespecificeerd dat dit soort interacties directioneel is (in tegenstelling tot ionische lading-lading-interacties). De moleculen in hun omgeving oriënteren hun polen zodanig dat, hoewel ze zwak zijn, de som van al deze interacties de verbinding een grote intermoleculaire stabiliteit geeft..
Dit heeft tot gevolg dat verbindingen (organisch of anorganisch) die dipool-dipool-interacties kunnen vormen, hoge kook- of smeltpunten vertonen..
Artikel index
- 1 dipoolmoment
- 1.1 Symmetrie
- 1.2 Asymmetrie in niet-lineaire moleculen
- 2 Oriëntaties van de dipolen
- 3 Interacties door waterstofbruggen
- 4 referenties
Dipool moment
Het dipoolmoment µ van een molecuul is een vectorgrootheid. Met andere woorden: het hangt af van de richtingen waarin er een polariteitsgradiënt is. Hoe en waarom komt deze gradiënt tot stand? Het antwoord ligt in de bindingen en in de intrinsieke aard van de atomen van de elementen..
In de bovenste afbeelding is A bijvoorbeeld elektronegatiever dan B, dus in de A-B-binding bevindt de hoogste elektronendichtheid zich rond A.
Aan de andere kant "geeft" B zijn elektronenwolk op en is daarom omgeven door een elektronenarm gebied. Dit verschil in elektronegativiteiten tussen A en B creëert de polariteitsgradiënt.
Omdat het ene gebied rijk is aan elektronen (δ-) terwijl het andere arm is aan elektronen (δ +), verschijnen de twee polen die, afhankelijk van de afstanden ertussen, verschillende groottes van µ veroorzaken, die voor elke verbinding wordt bepaald..
Symmetrie
Als een molecuul van een bepaalde verbinding µ = 0 heeft, dan wordt er gezegd dat het een apolair molecuul is (zelfs als het polariteitsgradiënten heeft).
Om te begrijpen hoe symmetrie - en dus moleculaire geometrie - een belangrijke rol speelt in deze parameter, is het nodig om de A-B binding opnieuw te beschouwen..
Vanwege het verschil in elektronegativiteit zijn er bepaalde gebieden die rijk en arm zijn aan elektronen.
Wat als de links A-A of B-B waren? In deze moleculen zou er geen dipoolmoment zijn, omdat beide atomen op dezelfde manier de elektronen van de binding naar zich toe trekken (honderd procent covalente binding).
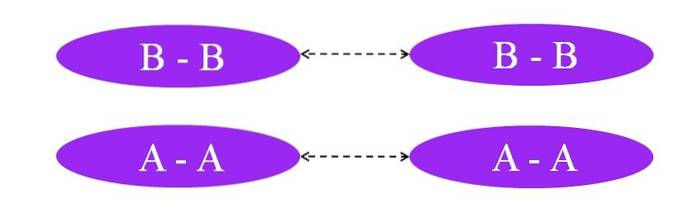
Zoals op de afbeelding te zien is, zijn er noch in molecuul A-A noch in molecuul B-B nu gebieden die rijk of arm zijn aan elektronen (rood en blauw). Hier is een ander soort kracht verantwoordelijk voor het bijeenhouden van Atwee en Btwee: geïnduceerde dipool-dipool-interacties, ook bekend als Londense krachten of verstrooiingskrachten.
Als de moleculen daarentegen van het AOA- of BOB-type waren, zouden er afstotingen zijn tussen hun polen omdat ze gelijke ladingen hebben:
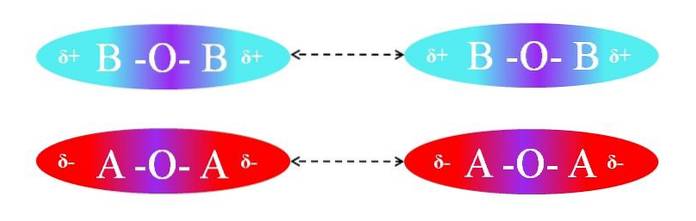
De δ + -regio's van twee BOB-moleculen laten geen efficiënte dipool-dipool-interactie toe; hetzelfde geldt voor de δ-regio's van de twee AOA-moleculen. Evenzo hebben beide paren moleculen µ = 0. De O-A-polariteitsgradiënt wordt vectorieel geannuleerd met die van de A-O-binding.
Dientengevolge spelen dispersiekrachten ook een rol in het AOA- en BOB-paar, vanwege het ontbreken van een effectieve oriëntatie van de dipolen..
Asymmetrie in niet-lineaire moleculen
Het eenvoudigste geval is dat van het CF-molecuul4 (of typ CX4Hier heeft C een tetraëdrische moleculaire geometrie en elektronenrijke gebieden bevinden zich op de hoekpunten, met name op de elektronegatieve atomen van F.
De polariteitsgradiënt C-F annuleert in elk van de richtingen van de tetraëder, waardoor de vectorsom van al deze gelijk is aan 0.
Dus hoewel het centrum van de tetraëder erg positief is (δ +) en zijn hoekpunten erg negatief (δ-), kan dit molecuul geen dipool-dipoolinteracties vormen met andere moleculen..
Oriëntaties van de dipolen
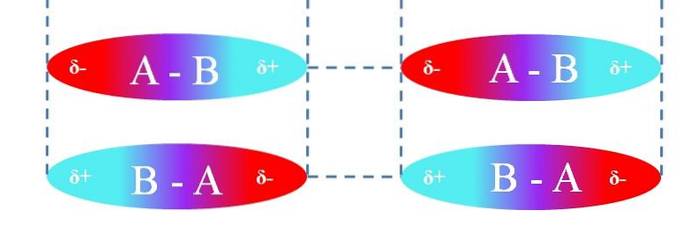
In het geval van lineaire A-B-moleculen zijn ze zo georiënteerd dat ze de meest efficiënte dipool-dipool-interacties vormen (zoals te zien is in de afbeelding hierboven). Het bovenstaande is op dezelfde manier van toepassing op andere moleculaire geometrieën; bijvoorbeeld de hoekige in het geval van NO-moleculentwee.
Deze interacties bepalen dus of verbinding A-B een gas, een vloeistof of een vaste stof is bij kamertemperatuur..
In het geval van verbindingen Atwee en Btwee (die van de paarse ellipsen), is het zeer waarschijnlijk dat ze gasvormig zijn. Als de atomen echter erg omvangrijk en gemakkelijk polariseerbaar zijn (waardoor de krachten van Londen toenemen), kunnen beide verbindingen vast of vloeibaar zijn..
Hoe sterker de dipool-dipool-interacties, hoe groter de cohesie tussen de moleculen; evenzo, hoe hoger het smelt- en kookpunt van de verbinding. Dit komt doordat hogere temperaturen nodig zijn om deze interacties te "verbreken"..
Aan de andere kant zorgt een temperatuurstijging ervoor dat de moleculen vaker trillen, roteren en bewegen. Deze "moleculaire agitatie" schaadt de oriëntaties van de dipolen en daardoor worden de intermoleculaire krachten van de verbinding verzwakt..
Interacties met waterstofbruggen
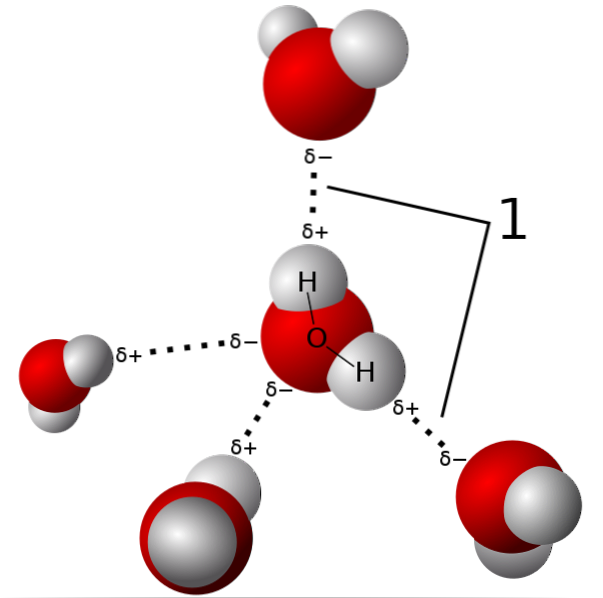
In de bovenstaande afbeelding worden vijf watermoleculen getoond die op elkaar inwerken door waterstofbruggen. Dit is een speciaal type dipool-dipool-interacties. Het elektronenarme gebied wordt ingenomen door H; en het gebied dat rijk is aan elektronen (δ-) wordt ingenomen door de sterk elektronegatieve atomen N, O en F.
Dat wil zeggen dat moleculen met N-, O- en F-atomen gebonden aan H waterstofbruggen kunnen vormen..
Waterstofbindingen zijn dus O-H-O, N-H-N en F-H-F, O-H-N, N-H-O, enz. Deze moleculen hebben permanente en zeer intense dipoolmomenten, die ze correct oriënteren om "te profiteren" van deze bruggen..
Ze zijn energetisch zwakker dan enige covalente of ionische binding. Hoewel de som van alle waterstofbruggen in de fase van een verbinding (vast, vloeibaar of gasvormig) ervoor zorgt dat het eigenschappen vertoont die het als uniek definiëren..
Dit is bijvoorbeeld het geval met water, waarvan de waterstofbruggen verantwoordelijk zijn voor het hoge kookpunt ervan en voor een lagere dichtheid in de ijstoestand dan vloeibaar water; reden waarom ijsbergen in zeeën drijven.
Referenties
- Dipool-dipoolkrachten. Opgehaald op 30 mei 2018, vanuit: chem.purdue.edu
- Grenzeloos leren. Dipool-dipoolkracht. Opgehaald op 30 mei 2018, van: courses.lumenlearning.com
- Jennifer Roushar. (2016). Dipool-dipoolkrachten. Opgehaald op 30 mei 2018, van: sophia.org
- Helmenstine, Anne Marie, Ph.D. (3 mei 2018). Wat zijn voorbeelden van waterstofbruggen? Opgehaald op 30 mei 2018, van: thoughtco.com
- Mathews, C. K., Van Holde, K.E. en Ahern, K.G. (2002) Biochemie. Derde editie. Addison Wesley Longman, Inc., P 33.
- Whitten, Davis, Peck & Stanley. Chemie. (8e ed.). CENGAGE Leren, p 450-452.
- Gebruiker Qwerter. (16 april 2011). 3D-model waterstofbruggen in toilet. [Figuur]. Opgehaald op 30 mei 2018, van: commons.wikimedia.org

Niemand heeft nog op dit artikel gereageerd.