
Tweede wet van thermodynamische formules, vergelijkingen, voorbeelden
De Tweede wet van de thermodynamica het heeft verschillende uitdrukkingsvormen. Een van hen stelt dat geen enkele warmtemotor in staat is om alle energie die hij absorbeert volledig om te zetten in bruikbaar werk (formule Kelvin-Planck). Een andere manier om het te zeggen is door te zeggen dat echte processen zo plaatsvinden dat de kwaliteit van energie lager is omdat de entropie neigt toe te nemen.
Deze wet, ook wel bekend als het tweede principe van de thermodynamica, is in de loop van de tijd op verschillende manieren uitgedrukt, van het begin van de 19e eeuw tot het heden, hoewel de oorsprong dateert van de oprichting van de eerste stoommachines in Engeland., Aan het begin van de 18e eeuw.

Maar hoewel het op vele manieren wordt uitgedrukt, is het idee dat materie de neiging heeft om wanordelijk te raken en dat geen enkel proces 100% efficiënt is, aangezien er altijd verliezen zullen bestaan..
Alle thermodynamische systemen houden zich aan dit principe, te beginnen met het universum zelf tot de ochtendkop koffie die rustig op tafel wacht en warmte uitwisselt met de omgeving..
De koffie koelt af naarmate de tijd verstrijkt, totdat hij in thermisch evenwicht is met de omgeving, dus het zou heel verrassend zijn als op een dag het tegenovergestelde zou gebeuren en de omgeving zou afkoelen terwijl de koffie zichzelf opwarmde. Het is onwaarschijnlijk, sommigen zullen zeggen dat het onmogelijk is, maar stel je het eens voor om een idee te krijgen van de manier waarop dingen spontaan gebeuren.
In een ander voorbeeld, als we een boek over het oppervlak van een tafel schuiven, zal het uiteindelijk stoppen, omdat de kinetische energie door wrijving verloren gaat als warmte..
De eerste en tweede wetten van de thermodynamica werden rond 1850 vastgesteld, dankzij wetenschappers zoals Lord Kelvin - schepper van de term "thermodynamica" -, William Rankine - auteur van de eerste formele tekst over thermodynamica - en Rudolph Clausius..
Artikel index
- 1 Formules en vergelijkingen
- 1.1 Omkeerbare en onomkeerbare processen
- 2 Toepassingen
- 2.1 Carnot-motor
- 2.2 Humaan metabolisme
- 3 voorbeelden
- 4 Opgeloste oefeningen
- 4.1 Oefening 1
- 4.2 Oefening 2
- 4.3 Oefening 3
- 5 referenties
Formules en vergelijkingen
Entropie - in het begin genoemd - helpt ons om vast te stellen in welke zin dingen gebeuren. Laten we teruggaan naar het voorbeeld van lichamen in thermisch contact.
Wanneer twee objecten met verschillende temperaturen in contact komen en uiteindelijk na een tijdje een thermisch evenwicht bereiken, worden ze ernaartoe gedreven door het feit dat de entropie zijn maximum bereikt, wanneer de temperatuur van beide hetzelfde is.
Entropie aanduiden als S, de verandering in entropie AS van een systeem wordt gegeven door:

De verandering van entropie AS geeft de mate van wanorde in een systeem aan, maar er is een beperking in het gebruik van deze vergelijking: deze is alleen van toepassing op omkeerbare processen, dat wil zeggen processen waarin het systeem kan terugkeren naar zijn oorspronkelijke staat zonder een spoor achter te laten van wat er is gebeurd-.
In onomkeerbare processen lijkt de tweede wet van de thermodynamica als volgt:

Omkeerbare en onomkeerbare processen
De kop koffie wordt altijd koud en is een goed voorbeeld van een onomkeerbaar proces, aangezien het altijd maar in één richting plaatsvindt. Als je room aan de koffie toevoegt en shake, krijg je een hele prettige combinatie, maar hoeveel je ook shaakt, je hebt de koffie en de room niet apart, want roeren is onomkeerbaar..

Hoewel de meeste dagelijkse processen onomkeerbaar zijn, zijn sommige dat ook bijna omkeerbaar. Omkeerbaarheid is een idealisering. Om dit te laten gebeuren, moet het systeem heel langzaam veranderen, zodanig dat het op elk punt altijd in evenwicht is. Op deze manier is het mogelijk om het terug te brengen naar een vorige staat zonder een spoor achter te laten in de omgeving..
Processen die dicht bij dit ideaal liggen, zijn efficiënter, omdat ze meer werk opleveren met minder energieverbruik..
De wrijvingskracht is verantwoordelijk voor een groot deel van de onomkeerbaarheid, omdat de warmte die hierdoor wordt gegenereerd niet het type energie is dat wordt gezocht. In het boek dat over de tafel glijdt, is wrijvingswarmte energie die niet wordt teruggewonnen.
Hoewel het boek terugkeert naar zijn oorspronkelijke positie, zal de tafel heet zijn geweest als een spoor van komen en gaan.
Kijk nu eens naar een gloeilamp: het meeste werk dat door de stroom door de gloeidraad wordt gedaan, gaat door het joule-effect in warmte verloren. Slechts een klein percentage wordt gebruikt om licht uit te stralen. In beide processen (boek en gloeilamp) is de entropie van het systeem toegenomen.
Toepassingen
Een ideale motor is er een die is gebouwd met behulp van omkeerbare processen en geen wrijving heeft die energieverspilling veroorzaakt, omzetting bijna alle warmte-energie in bruikbaar werk.
We benadrukken het woord bijna, want zelfs de ideale motor, die van Carnot is, is niet 100% efficiënt. De tweede wet van de thermodynamica zorgt ervoor dat dit niet het geval is.
Carnot-motor
De Carnot-motor is de meest efficiënte motor die kan worden bedacht. Het werkt tussen twee temperatuurtanks in twee isotherme processen - bij constante temperatuur - en twee adiabatische processen - zonder overdracht van thermische energie-.
De grafieken met de naam PV -druk-volume-diagrammen geven de situatie in één oogopslag inzichtelijk:
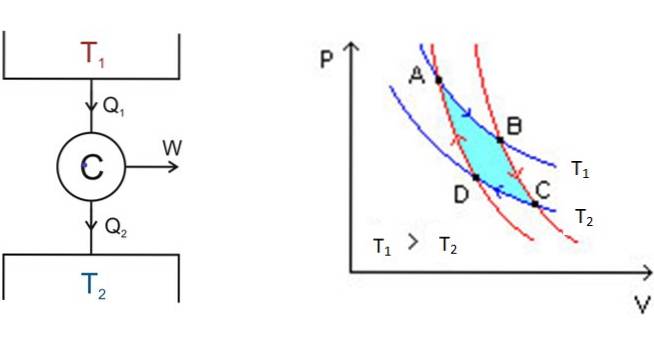
Aan de linkerkant, in figuur 3, is het diagram van de Carnot-motor C, die warmte Q opneemt1 van de tank die op temperatuur T is1, zet die warmte om in werk W en levert het afval Q optwee naar de koudste tank, die zich op temperatuur T bevindttwee.
Beginnend bij A, zet het systeem uit tot het B bereikt, waarbij het warmte absorbeert bij de vaste temperatuur T1. In B begint het systeem een adiabatische expansie waarbij geen warmte wordt gewonnen of verloren gaat om C te bereiken.
In C begint een ander isotherm proces: dat van het overbrengen van warmte naar de andere koudere thermische afzetting die zich op T bevindttwee. Terwijl dit gebeurt, wordt het systeem gecomprimeerd en bereikt het punt D.Er begint een tweede adiabatisch proces om terug te keren naar het beginpunt A. Op deze manier wordt een cyclus voltooid.
De efficiëntie van de Carnot-motor hangt af van de temperaturen in Kelvin van de twee thermische reservoirs:
Maximale efficiëntie = (Qbinnenkomst - QUitgang) / Qbinnenkomst 1 - (T.twee/ T1
Volgens de stelling van Carnot is dit de meest efficiënte warmtemotor die er is, maar koop hem niet te snel. Weet je nog wat we zeiden over omkeerbaarheid van processen? Ze moeten heel, heel langzaam gebeuren, dus het vermogen van deze machine is praktisch nul..
Menselijke stofwisseling
Mensen hebben energie nodig om al hun systemen te laten werken, daarom gedragen ze zich als thermische machines die energie ontvangen en deze omzetten in mechanische energie om bijvoorbeeld te bewegen.
Efficiëntie en van het menselijk lichaam tijdens het werk kan worden gedefinieerd als het quotiënt tussen het mechanische vermogen dat het kan leveren en de totale energie-input, die wordt geleverd met voedsel.
Als het gemiddelde vermogen Pm is werk W gedaan in een tijdsinterval Δt, kan worden uitgedrukt als:
P.m = W / Δt
Ja ΔU / Δt is de snelheid waarmee energie wordt toegevoegd, de lichaamsefficiëntie is als:
Door talloze tests met vrijwilligers zijn rendementen tot 17% behaald, met een vermogen van ongeveer 100 watt gedurende meerdere uren.
Dat hangt natuurlijk in grote mate af van de taak die wordt uitgevoerd. Het trappen op een fiets is iets efficiënter, ongeveer 19%, terwijl repetitieve taken met schoppen, houwelen en schoffels slechts ongeveer 3% zijn..
Voorbeelden
De tweede wet van de thermodynamica is impliciet in alle processen die plaatsvinden in het heelal. Entropie neemt altijd toe, hoewel het in sommige systemen lijkt af te nemen. Om dit te laten gebeuren, heeft het elders moeten stijgen, zodat het in de totale balans positief is.
- Bij het leren is er entropie. Er zijn mensen die dingen goed en snel leren, en die ze later ook gemakkelijk kunnen onthouden. Er wordt gezegd dat het mensen zijn met een lage entropie, maar ze zijn zeker minder talrijk dan mensen met een hoge entropie: degenen die het moeilijker vinden om de dingen die ze bestuderen te onthouden.
- Een bedrijf met ongeorganiseerde werknemers heeft meer entropie dan een waarin werknemers taken op een ordelijke manier uitvoeren. Het is duidelijk dat de laatste efficiënter zal zijn dan de eerste.
- Wrijvingskrachten genereren minder efficiëntie bij het bedienen van machines, omdat ze de hoeveelheid gedissipeerde energie vergroten die niet efficiënt kan worden gebruikt.
- Het gooien van een dobbelsteen heeft een hogere entropie dan het opgooien van een munt. Per slot van rekening heeft het opgooien van een munt maar 2 mogelijke uitkomsten, terwijl het opgooien van de dobbelsteen er 6 heeft. Hoe meer gebeurtenissen er waarschijnlijk zijn, hoe meer entropie er is..
Opgeloste oefeningen
Oefening 1
Een zuigercilinder wordt gevuld met een mengsel van vloeistof en waterdamp van 300 K en 750 kJ warmte wordt via een constant drukproces op het water overgedragen. Als gevolg hiervan verdampt de vloeistof in de cilinder. Bereken de verandering in entropie in het proces.

Oplossing
Het proces beschreven in de verklaring wordt uitgevoerd bij constante druk in een gesloten systeem, dat geen massa-uitwisseling ondergaat.
Omdat het een verdamping is, waarbij de temperatuur ook niet verandert (tijdens faseveranderingen is de temperatuur constant), kan de hierboven gegeven definitie van entropieverandering worden toegepast en kan de temperatuur buiten de integraal gaan:
ΔS = 750.000 J / 300 K = 2500 J / K.
Omdat warmte het systeem binnenkomt, is de verandering in entropie positief.
Oefening 2
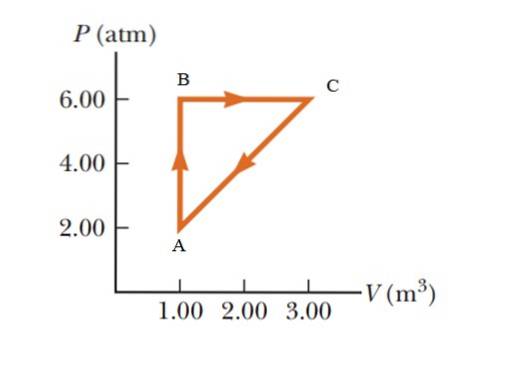
Een gas ondergaat een druktoename van 2,00 naar 6,00 atmosfeer (atm), waarbij een constant volume van 1,00 m wordt gehandhaafd3, en vervolgens uitzetten bij constante druk tot een volume van 3,00 m wordt bereikt3. Ten slotte keert het terug naar zijn oorspronkelijke staat. Bereken hoeveel werk er in 1 cyclus wordt gedaan.

Oplossing
Het is een cyclisch proces waarbij de interne energievariatie nul is, volgens de eerste wet van de thermodynamica, dus Q = W. de curve. Om de resultaten in het internationale systeem weer te geven, is het noodzakelijk om een eenheidsverandering in druk door te voeren met behulp van de volgende omrekeningsfactor:
1 atm = 101,325 kPa = 101,325 Pa.
Het door de grafiek omsloten gebied komt overeen met dat van een driehoek waarvan de basis (3-1 m3) = 2 m3 en waarvan de hoogte (6 - 2 atm) = 4 atm = 405.300 Pa is
W.ABCA = ½ (2 m3 x 405300 Pa) = 405300 J = 405,3 kJ.
Oefening 3
Een van de meest efficiënte machines die ooit is gebouwd, is naar verluidt een kolengestookte stoomturbine aan de Ohio-rivier, die wordt gebruikt om een elektrische generator van stroom te voorzien die tussen 1870 en 430 ° C werkt..
Bereken: a) de maximale theoretische efficiëntie, b) het mechanische vermogen dat door de machine wordt geleverd als deze 1,40 x 10 absorbeert5 J energie elke seconde uit de hete tank. Het werkelijke rendement is bekend als 42,0%.
Oplossing
a) De maximale efficiëntie wordt berekend met de bovenstaande vergelijking:
Maximale efficiëntie = (Qbinnenkomst - Q Uitgang) / Qbinnenkomst 1 - (T.twee/ T1
Om de graden Celsius te veranderen in Kelvin, voegt u 273.15 toe aan de Celsius temperatuur:

Vermenigvuldigen met 100% geeft het maximale efficiëntiepercentage, namelijk 67,2%
c) Als de werkelijke efficiëntie 42% is, is er een maximale efficiëntie van 0,42.
Het geleverde mechanische vermogen is: P = 0,42 x 1,40 x10 5 J / s = 58800 W.
Referenties
- Bauer, W. 2011. Physics for Engineering and Sciences. Deel 1. Mc Graw Hill.
- Cengel, Y. 2012. Thermodynamica. 7ma Editie. Mcgraw heuvel.
- Figueroa, D. (2005). Serie: Physics for Science and Engineering. Deel 4. Vloeistoffen en thermodynamica. Bewerkt door Douglas Figueroa (USB).
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach.
- López, C. De eerste wet van de thermodynamica. Hersteld van: culturacientifica.com.
- Serway, R. 2011. Fundamentals of Physics. 9na Cengage leren.
- Sevilla Universiteit. Thermische machines. Hersteld van: laplace.us.es



Niemand heeft nog op dit artikel gereageerd.