
Moleculaire kinetische theorie geschiedenis, postulaten en voorbeelden

De moleculaire kinetische theorie Het is er een die de experimentele waarnemingen van gassen probeert te verklaren vanuit een microscopisch perspectief. Dat wil zeggen, het probeert de aard en het gedrag van de gasvormige deeltjes te associëren met de fysieke kenmerken van het gas als vloeistof; leg het macroscopisch uit vanuit het microscopisch.
Gassen zijn altijd interessant geweest voor wetenschappers vanwege hun eigenschappen. Ze bezetten het volledige volume van de container waarin ze worden aangetroffen en kunnen volledig worden samengedrukt zonder dat hun inhoud de minste weerstand biedt; en als de temperatuur stijgt, begint de container uit te zetten en kan deze zelfs barsten.
Veel van deze eigenschappen en gedragingen zijn samengevat in de ideale gaswetten. Ze beschouwen het gas echter als een geheel en niet als een verzameling van miljoenen deeltjes die in de ruimte zijn verspreid; Bovendien geeft het op basis van druk-, volume- en temperatuurgegevens geen verdere informatie over hoe deze deeltjes bewegen.
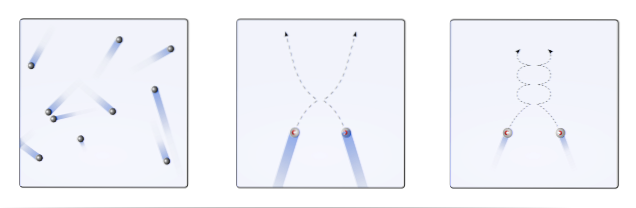
Op dat moment stelt de moleculaire kinetische theorie (TCM) voor om ze als mobiele bollen te visualiseren (bovenste afbeelding). Deze bollen komen willekeurig met elkaar en de wanden in botsing en handhaven een lineair traject. Wanneer de temperatuur echter afneemt en de druk toeneemt, wordt het traject van de bollen gekromd..
Een gas zou zich volgens TCM moeten gedragen als de bollen in het eerste frame van de afbeelding. Maar door af te koelen en de druk op hen te verhogen, is hun gedrag verre van ideaal. Het zijn dan echte gassen, die bijna vloeibaar worden gemaakt en dus naar de vloeistoffase gaan.
Onder deze omstandigheden worden de interacties tussen de bollen belangrijker, tot het punt dat hun snelheden tijdelijk vertragen. Hoe dichter ze bij liquefactie zijn, hoe bochtiger hun banen worden (inzet aan de rechterkant) en hoe minder energiek hun botsingen.
Artikel index
- 1 Geschiedenis
- 1.1 Daniel Bernoulli
- 1.2 Rudolf Clausius
- 1.3 James Clerk Maxwell en Ludwig Boltzmann
- 2 Postulaten van moleculaire kinetische theorie
- 2.1 Het volume van de gasvormige deeltjes is verwaarloosbaar
- 2.2 De aantrekkingskracht tussen de deeltjes is nul
- 2.3 Gasvormige deeltjes zijn altijd in beweging
- 2.4 Botsingen tussen deeltjes en containerwanden zijn elastisch
- 2.5 Kinetische energie blijft niet constant
- 2.6 De gemiddelde kinetische energie is voor alle gassen gelijk aan een gegeven temperatuur
- 3 voorbeelden
- 3.1 De wet van Boyle
- 3.2 Charles's Law
- 3.3 De wet van Dalton
- 4 referenties
Verhaal
Daniel Bernoulli
Het idee van deze sferen, beter atomen genoemd, was al overwogen door de Romeinse filosoof Lucretius; niet voor gassen, maar voor vaste, statische objecten. Aan de andere kant paste Daniel Bernoulli in 1738 de atomaire visie toe op gassen en vloeistoffen door ze voor te stellen als ongeordende bollen die in alle richtingen bewegen..
Zijn werk was in die tijd echter in strijd met de wetten van de fysica; een lichaam kon niet eeuwig bewegen, dus het was onmogelijk om te denken dat een reeks atomen en moleculen met elkaar zouden botsen zonder hun energie te verliezen; dat wil zeggen, het bestaan van elastische botsingen was niet mogelijk.
Rudolf Clausius
Een eeuw later versterkten andere auteurs TCM met een model waarbij de gasvormige deeltjes slechts in één richting bewogen. Rudolf Clausius verzamelde echter zijn resultaten en stelde een completer TCM-model samen waarmee hij de ideale gaswetten probeerde uit te leggen die door Boyle, Charles, Dalton en Avogadro waren gedemonstreerd..
James Clerk Maxwell en Ludwig Boltzmann
In 1859 verklaarde James Clerk Maxwell dat gasvormige deeltjes een reeks snelheden vertonen bij een bepaalde temperatuur, en dat een reeks ervan kan worden beschouwd door middel van een gemiddelde moleculaire snelheid..
Toen, in 1871, verbond Ludwig Boltzmann bestaande ideeën met entropie, en hoe gas thermodynamisch altijd de neiging heeft om zoveel mogelijk ruimte homogeen en spontaan in te nemen.
Postulaten van moleculaire kinetische theorie
Om het gas als zijn deeltjes te beschouwen, is een model nodig waarin aan bepaalde postulaten of aannames wordt voldaan; stelt dat macroscopische en experimentele waarnemingen logischerwijs (zo nauwkeurig mogelijk) moeten kunnen voorspellen en verklaren. Dat gezegd hebbende, worden de TCM-postulaten genoemd en beschreven.
Het volume van de gasvormige deeltjes is verwaarloosbaar
In een container gevuld met gasvormige deeltjes verspreiden deze zich en bewegen ze in alle hoeken van elkaar weg. Als ze voor een moment allemaal op een bepaald punt in de container zouden kunnen worden samengebracht, zonder vervloeiing, zou worden opgemerkt dat ze slechts een verwaarloosbaar deel van het volume van de container innemen..
Het betekent dat de container, zelfs als deze miljoenen gasvormige deeltjes bevat, eigenlijk meer leeg dan vol is (volume-leegte-verhouding veel minder dan 1); daarom, als zijn barrières het toelaten, kunnen het en het gas erin abrupt worden samengedrukt; aangezien de deeltjes aan het eind van de dag erg klein zijn, evenals hun volume.
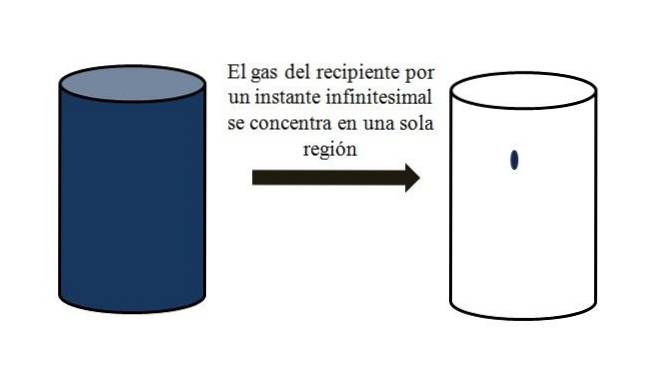
De bovenste afbeelding illustreert het bovenstaande nauwkeurig, met behulp van een blauwachtig gas.
De aantrekkingskracht tussen de deeltjes is nul
De gasvormige deeltjes in de container komen met elkaar in botsing zonder voldoende tijd om hun interacties sterker te maken; nog minder als wat hen voornamelijk omringt, moleculair vacuüm is. Een direct gevolg hiervan is dat hun lineaire paden hen in staat stellen om het volume van de container volledig te omringen..
Als dit niet het geval was, zou een container met een "bizarre" en "labyrintische" vorm vochtige gebieden hebben als gevolg van gascondensatie; in plaats daarvan reizen de deeltjes met volledige vrijheid door de container, zonder dat de kracht van hun interacties hen tegenhoudt.
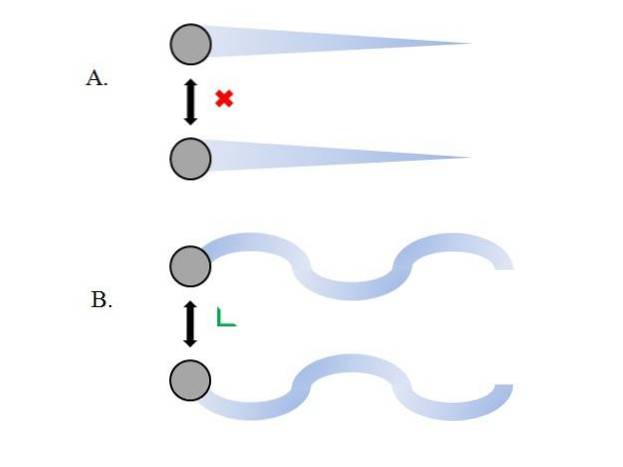
De lineaire trajecten van de bovenste afbeelding (A.) demonstreren dit postulaat; terwijl als de banen gekromd zijn (B.), het laat zien dat er interacties zijn die niet kunnen worden genegeerd tussen de deeltjes.
Gasvormige deeltjes zijn altijd in beweging
Uit de eerste twee postulaten convergeert ook het feit dat de gasdeeltjes nooit stoppen met bewegen. Eenmaal vervaagd in de container, komen ze met elkaar en met de wanden in botsing met een kracht en snelheid die recht evenredig is met de absolute temperatuur; deze kracht is, druk.
Als de gasvormige deeltjes even ophielden, zouden 'rooktonen' in de container worden waargenomen, die uit het niets tevoorschijn kwamen, met voldoende tijd om zichzelf in een vacuüm te rangschikken en willekeurige vormen te geven..
Botsingen tussen de deeltjes en de wanden van de container zijn elastisch
Als alleen elastische botsingen tussen de gasdeeltjes en de wanden van de container in de container overheersen, zal er nooit condensatie van het gas optreden (zolang de fysieke omstandigheden niet veranderen); of wat is hetzelfde als zeggen dat ze nooit rusten en altijd in botsing komen.
Dit komt doordat er bij elastische botsingen geen netto verlies van kinetische energie is; een deeltje botst tegen de muur en stuitert met dezelfde snelheid. Als een deeltje bij het botsen vertraagt, versnelt het andere, zonder warmte of geluid te produceren dat de kinetische energie van een van beide verdrijft.
Kinetische energie blijft niet constant
De beweging van de deeltjes is willekeurig en chaotisch, zodat ze niet allemaal dezelfde snelheid hebben; net zoals het gebeurt, bijvoorbeeld op een snelweg of in een menigte. Sommige zijn energieker en reizen sneller, terwijl andere langzaam zijn en wachten op een botsing om ze te versnellen.
Om zijn snelheid te beschrijven, is het dan nodig om een gemiddelde te berekenen; en hiermee wordt op hun beurt de gemiddelde kinetische energie van de gasvormige deeltjes of moleculen verkregen. Omdat de kinetische energie van alle deeltjes constant verandert, zorgt het gemiddelde voor een betere controle van de gegevens en kan er met grotere betrouwbaarheid worden gewerkt..
De gemiddelde kinetische energie is voor alle gassen gelijk aan een gegeven temperatuur
Gemiddelde moleculaire kinetische energie (ECsmp) in een container verandert met de temperatuur. Hoe hoger de temperatuur, hoe hoger de energie. Omdat het een gemiddelde is, kunnen er deeltjes of gassen zijn met een hogere of lagere energie dan deze waarde; sommige sneller en sommige langzamer.
Wiskundig kan worden aangetoond dat ECsmp het hangt uitsluitend af van de temperatuur. Dit betekent dat ongeacht het gas, de massa of moleculaire structuur, de ECsmp het zal hetzelfde zijn bij een temperatuur T en zal alleen variëren als het stijgt of daalt. Van alle postulaten is dit misschien wel het meest relevant..
En hoe zit het met de gemiddelde moleculaire snelheid? In tegenstelling tot ECsmp, moleculaire massa heeft invloed op de snelheid. Hoe zwaarder het gasvormige deeltje of molecuul, het is normaal om te verwachten dat het langzamer beweegt..
Voorbeelden
Hier zijn enkele korte voorbeelden van hoe TCM erin is geslaagd de ideale gaswetten uit te leggen. Hoewel niet behandeld, kunnen andere verschijnselen, zoals gasdiffusie en effusie, ook worden verklaard met TCM.
De wet van Boyle
Als het volume van de container bij constante temperatuur wordt samengeperst, wordt de afstand die de gasvormige deeltjes moeten afleggen om tegen de wanden te botsen kleiner; wat gelijk staat aan een toename van de frequentie van dergelijke botsingen, resulterend in een grotere druk. Omdat de temperatuur constant blijft, wordt ECsmp het is ook constant.
Charles Law
Als je T verhoogt, ECsmp zal toenemen. De gasvormige deeltjes zullen sneller bewegen en een groter aantal keren botsen met de wanden van de container; dus de druk neemt toe.
Als de wanden flexibel zijn, in staat zijn uit te zetten, wordt hun oppervlak groter en zal de druk dalen totdat deze constant wordt; en als resultaat zal het volume ook toenemen.
De wet van Dalton
Als meerdere liters verschillende gassen zouden worden toegevoegd aan een ruime container, afkomstig uit kleinere containers, zou de totale interne druk gelijk zijn aan de som van de partiële drukken die door elk type gas afzonderlijk worden uitgeoefend..
Waarom? Omdat alle gassen met elkaar beginnen te botsen en zich homogeen verspreiden; de interacties daartussen zijn nul, en het vacuüm overheerst in de container (TCM postuleert), dus het is alsof elk gas alleen is, zijn druk individueel uitoefent zonder de tussenkomst van de andere gassen.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren, P 426-431.
- Fernandez Pablo. (2019). Moleculaire kinetische theorie. Vix. Hersteld van: vix.com
- Jones, Andrew Zimmerman. (7 februari 2019). Kinetic Molecular Theory of Gases. Hersteld van: thoughtco.com
- Hall Nancy. (5 mei 2015). Kinetische theorie van gassen. Glenn Research Center. Hersteld van: grc.nasa.gov
- Blaber M. & Lower S. (9 oktober 2018). Basisprincipes van kinetische moleculaire theorie. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- De kinetische moleculaire theorie. Hersteld van: chemed.chem.purdue.edu
- Wikipedia. (2019). Kinetische theorie van gassen. Hersteld van: en.wikipedia.org
- Toppr. (s.f.). Kinetische moleculaire theorie van gassen. Hersteld van: toppr.com



Niemand heeft nog op dit artikel gereageerd.