
Siliciumgeschiedenis, eigenschappen, structuur, verkrijgen, gebruik
De silicium Het is een niet-metallisch en tegelijkertijd metalloïde element dat wordt weergegeven door het chemische symbool Si. Het is een halfgeleider, die een essentieel onderdeel is van computers, rekenmachines, mobiele telefoons, zonnecellen, diodes, enz .; Het is praktisch het belangrijkste onderdeel dat de oprichting van het digitale tijdperk mogelijk heeft gemaakt.
Silicium is altijd aanwezig geweest in kwarts en silicaten, beide mineralen vormen ongeveer 28 massaprocent van de hele aardkorst. Het is dus het op een na meest voorkomende element op het aardoppervlak, en de uitgestrektheid van de woestijnen en stranden bieden een perspectief van hoe overvloedig het is..

Silicium behoort tot groep 14 van het periodiek systeem, hetzelfde als koolstof, dat zich eronder bevindt. Daarom wordt dit element beschouwd als een vierwaardige metalloïde; Het heeft vier valentie-elektronen en in theorie kan het ze allemaal verliezen om het kation Si te vormen4+.
Een eigenschap die het deelt met steenkool is het vermogen om met elkaar te verbinden; dat wil zeggen, hun atomen zijn covalent verbonden om moleculaire ketens te definiëren. Evenzo kan silicium zijn eigen "koolwaterstoffen" vormen, silanen genaamd..
De overheersende verbindingen van silicium in de natuur zijn de beroemde silicaten. In zijn pure vorm kan het verschijnen als een monokristallijne, polykristallijne of amorfe vaste stof. Het is een relatief inerte vaste stof, dus het brengt geen grote risico's met zich mee.
Artikel index
- 1 Geschiedenis
- 1.1 De siliconensteen
- 1.2 Isolatie
- 1.3 Kristallijn silicium
- 2 Fysische en chemische eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molaire massa
- 2.3 Atoomnummer (Z)
- 2.4 Smeltpunt
- 2.5 Kookpunt
- 2.6 Dichtheid
- 2.7 Warmte van fusie
- 2.8 Verdampingswarmte
- 2,9 Molaire warmtecapaciteit
- 2.10 Elektronegativiteit
- 2.11 Ionisatie-energieën
- 2.12 Atoomradius
- 2.13 Thermische geleidbaarheid
- 2.14 Elektrische weerstand
- 2.15 Mohs-hardheid
- 2.16 Aaneenschakeling
- 2.17 oxidatienummers
- 2.18 Reactiviteit
- 3 Structuur en elektronische configuratie
- 3.1 Covalent karakter
- 3.2 Elektrische geleidbaarheid
- 3.3 Amorf silicium
- 4 Waar te vinden en te verkrijgen
- 4.1 - Vermindering van silica
- 5 isotopen
- 6 Risico's
- 7 toepassingen
- 7.1 Bouwsector
- 7.2 Glas en keramiek
- 7.3 Legeringen
- 7.4 Droogmiddelen
- 7.5 Elektronische industrie
- 7.6 Siliconenpolymeren
- 8 referenties
Verhaal
Silicium steen
Silicium is misschien wel een van de elementen die de meeste invloed heeft gehad in de geschiedenis van de mensheid.
Dit element is de hoofdrolspeler van het stenen tijdperk, en ook van het digitale tijdperk. De oorsprong ervan gaat terug tot de tijd dat beschavingen ooit met kwarts werkten en hun eigen brillen maakten; en momenteel is het het belangrijkste onderdeel van computers, laptops en smartphones.
Silicium is praktisch de steen geweest van twee duidelijk gedefinieerde tijdperken in onze geschiedenis.
Isolatie
Omdat silica zo overvloedig is, een naam die is ontstaan uit vuursteen, moet het een buitengewoon rijk element in de aardkorst hebben bevat; dit was het juiste vermoeden van Antoine Lavoisier, die in 1787 faalde in zijn pogingen om het van zijn roest te verminderen.
Enige tijd later, in 1808, deed Humphry Davy zijn eigen pogingen en gaf het element zijn voornaam: 'silicium', wat vertaald zou worden als 'vuursteenmetaal'. Dat wil zeggen, silicium werd toen als een metaal beschouwd vanwege het gebrek aan karakterisering..
Toen slaagden de Franse chemici Joseph L. Gay-Lussac en Louis Jacques Thénard er in 1811 in om voor het eerst amorf silicium te bereiden. Hiervoor lieten ze het siliciumtetrafluoride reageren met metallisch kalium. Ze zuiverden of karakteriseerden het verkregen product echter niet, dus concludeerden ze niet dat het het nieuwe element silicium was.
Pas in 1823 verkreeg de Zweedse chemicus Jacob Berzelius een amorf silicium dat voldoende zuiver was om het als silicium te herkennen; naam gegeven in 1817 door de Schotse chemicus Thomas Thomson toen hij het als een niet-metallisch element beschouwde. Berzelius voerde de reactie uit tussen kaliumfluorsilicaat en gesmolten kalium om dit silicium te produceren.
Kristallijn silicium
Kristallijn silicium werd voor het eerst bereid in 1854 door de Franse chemicus Henry Deville. Om dit te bereiken, voerde Deville een elektrolyse uit van een mengsel van aluminium en natriumchloriden, waardoor siliciumkristallen werden verkregen die bedekt waren met een laag aluminiumsilicide, die hij (blijkbaar) verwijderde door ze te wassen met water..
Fysische en chemische eigenschappen
Fysiek uiterlijk

Silicium in zijn pure of elementaire vorm bestaat uit een grijsachtige of blauwzwarte vaste stof (bovenste afbeelding), die, hoewel het geen metaal is, glanzende gezichten heeft alsof het echt is.
Het is een harde maar broze vaste stof, die ook een schilferig oppervlak vertoont als hij uit polykristallen bestaat. Amorf silicium daarentegen ziet eruit als een donkerbruine poedervormige vaste stof. Dankzij dit is het gemakkelijk om het ene type silicium (kristallijn of polykristallijn) te identificeren en te onderscheiden van het andere (amorf).
Molaire massa
28,085 g / mol
Atoomnummer (Z)
14 (14Ja)
Smeltpunt
1414 ºC
Kookpunt
3265 ºC
Dichtheid
-Bij kamertemperatuur: 2,33 g / ml
-Precies op het smeltpunt: 2,57 g / ml
Merk op dat vloeibaar silicium een grotere dichtheid heeft dan vast silicium; wat betekent dat zijn kristallen zullen drijven op een vloeibare fase ervan, zoals het gebeurt met het ijswatersysteem. De verklaring is te wijten aan het feit dat de interatomaire ruimte tussen de Si-atomen in hun kristal groter (minder dicht) is dan de overeenkomstige ruimte in de vloeistof (dichter).
Warmte van fusie
50,21 kJ / mol
Warmte van verdamping
383 kJ / mol
Molaire warmtecapaciteit
19.789 J / (mol K)
Elektronegativiteit
1,90 op de schaal van Pauling
Ionisatie-energieën
-Ten eerste: 786,5 kJ / mol
-Ten tweede: 1577,1 kJ / mol
-Ten derde: 3231,6 kJ / mol
Atomaire radio
111 uur (gemeten op hun respectievelijke diamantkristallen)
Warmtegeleiding
149 W / (m · K)
Elektrische weerstand
2,3 103 Ω · m bij 20 ºC
Mohs-hardheid
6.5
Aaneenschakeling
Siliciumatomen hebben het vermogen om eenvoudige Si-Si-bindingen te vormen, die uiteindelijk een ketting vormen (Si-Si-Si ...).
Deze eigenschap komt ook tot uiting in koolstof en zwavel; sp-hybridisaties3 silicium zijn meer deficiënt in vergelijking met dat van de andere twee elementen en bovendien zijn hun 3p-orbitalen diffuser, dus de overlap van de sp-orbitalen3 resulterend is zwakker.
De gemiddelde energieën van de covalente bindingen Si-Si en C-C zijn respectievelijk 226 kJ / mol en 356 kJ / mol. Daarom zijn de Si-Si-bindingen zwakker. Daarom is silicium niet de hoeksteen van het leven (en zwavel ook niet). In feite is de langste ketting of het langste skelet dat silicium kan vormen gewoonlijk vierledige (Si4.
Oxidatienummers
Silicium kan een van de volgende oxidatiegetallen hebben, ervan uitgaande dat in elk van hen ionen met hun respectievelijke ladingen bestaan: -4 (Si4-), -3 (Ja3-), -2 (Jatwee-), -1 (Ja-), +1 (Ja+), +2 (Jatwee+), +3 (Ja3+) en +4 (Ja4+Van allemaal zijn -4 en +4 de belangrijkste.
Zo wordt in siliciden (MgtweeJa of mgtweetwee+Ja4-terwijl de +4 overeenkomt met die van silica (SiOtwee of als4+OFtweetwee-.
Reactiviteit
Silicium is volledig onoplosbaar in water, evenals sterke zuren of basen. Het lost echter op in een geconcentreerd mengsel van salpeterzuur en fluorwaterstofzuur (HNO3-HF). Evenzo lost het op in een hete alkalische oplossing, waarbij de volgende chemische reactie optreedt:
Si (s) + 2NaOH (aq) + HtweeO (l) => NatweeJa3(aq) + 2Htwee(g)
Het natriummetasilicaatzout, NatweeJa3, Het wordt ook gevormd wanneer silicium oplost in gesmolten natriumcarbonaat:
Si (s) + NatweeCO3(l) => NatweeJa3(l) + C (s)
Bij kamertemperatuur reageert het helemaal niet met zuurstof, zelfs niet bij 900 ºC, wanneer zich een beschermende glasachtige laag SiO begint te vormentweeen dan, bij 1400 ºC, reageert het silicium met de stikstof in de lucht om een mengsel van nitriden, SiN en Si te vormen3N4.
Silicium reageert ook bij hoge temperaturen met metalen om metaalsiliciden te vormen:
2Mg (s) + Si (s) => MgtweeJa (s)
2Cu (s) + Si (s) => CutweeJa (s)
Bij kamertemperatuur reageert het explosief en direct met halogenen (er is geen SiO-laagtwee om u hiertegen te beschermen). We hebben bijvoorbeeld de reactie van vorming van SiF4
Ja (s) + 2Ftwee(g) => SiF4(g)
En hoewel silicium onoplosbaar is in water, reageert het roodgloeiend met een dampstroom:
Ja (s) + HtweeO (g) => SiOtwee(s) + 2Htwee(g)
Structuur en elektronische configuratie
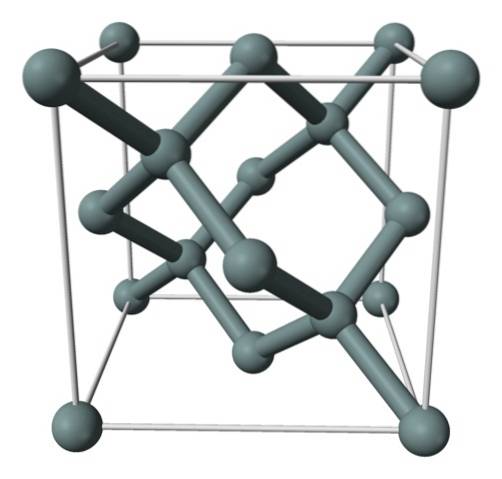
De afbeelding hierboven toont de vlakgecentreerde kubische structuur (fcc), dezelfde als die van diamant, voor siliciumkristal. De grijsachtige bollen komen overeen met de Si-atomen, die, zoals te zien is, covalent met elkaar verbonden zijn; Bovendien hebben ze tetraëdrische omgevingen die langs het kristal worden gereproduceerd.
Het siliciumkristal is fcc omdat een Si-atoom wordt waargenomen op elk van de vlakken van de kubus (6 × 1/2). Evenzo zijn er acht Si-atomen op de hoekpunten van de kubus (8 × 1/8) en vier erin (die een goed gedefinieerde tetraëder om hen heen laten zien, 4 × 1).
Dat gezegd hebbende, elke eenheidscel heeft in totaal acht siliciumatomen (3 + 1 + 4, cijfers aangegeven in de bovenstaande paragraaf); kenmerk dat de hoge hardheid en stijfheid helpt verklaren, aangezien puur silicium een covalent kristal is zoals diamant.
Covalent karakter
Dit covalente karakter is te wijten aan het feit dat silicium, net als koolstof, vier valentie-elektronen heeft volgens zijn elektronische configuratie:
[Ne] 3stwee 3ptwee
Voor binding zijn de pure 3s en 2p orbitalen nutteloos. Daarom creëert het atoom vier hybride sp-orbitalen3, waarmee het vier Si-Si covalente bindingen kan vormen en op deze manier het valentie-octet voor de twee siliciumatomen kan voltooien.
Het siliciumkristal wordt vervolgens gevisualiseerd als een covalent, driedimensionaal netwerk dat bestaat uit onderling verbonden tetraëders..
Dit netwerk is echter niet perfect, aangezien het defecten en korrelgrenzen heeft, die het ene kristal van het andere scheiden en definiëren; en als dergelijke kristallen erg klein en talrijk zijn, spreken we van een polykristallijne vaste stof, geïdentificeerd door zijn heterogene glans (vergelijkbaar met een zilvermozaïek of schilferig oppervlak).
Elektrische geleidbaarheid
De Si-Si-bindingen, met hun goed geplaatste elektronen, zijn in principe niet eens met wat er van een metaal wordt verwacht: een zee van elektronen die de atomen 'nat maken'; dit is tenminste zo bij kamertemperatuur.
Wanneer de temperatuur echter stijgt, begint het silicium elektriciteit te geleiden en gedraagt zich daarom als een metaal; dat wil zeggen, het is een halfgeleider-metalloïde element.
Amorf silicium
Siliciumtetraëders nemen niet altijd een structureel patroon aan, maar kunnen wanordelijk worden gerangschikt; en zelfs met siliciumatomen waarvan de hybridisaties niet sp3 maar sptwee, wat bijdraagt aan het verder vergroten van de mate van wanorde. Daarom spreken we van een amorf en niet-kristallijn silicium.
In amorf silicium zijn er elektronische vacatures, waarbij sommige van zijn atomen een orbitaal hebben met een ongepaard elektron. Hierdoor kan zijn vaste stof worden gehydrogeneerd, wat aanleiding geeft tot de vorming van gehydrogeneerd amorf silicium; dat wil zeggen, het heeft Si-H-bindingen, waarmee de tetraëders worden voltooid in ongeordende en willekeurige posities.
Deze sectie wordt vervolgens afgesloten met de opmerking dat silicium kan worden gepresenteerd in drie soorten vaste stoffen (zonder de zuiverheidsgraad te vermelden): kristallijn, polykristallijn en amorf..
Elk van hen heeft zijn eigen productiemethode of -proces, evenals zijn toepassingen en afwegingen bij het beslissen welke van de drie moet worden gebruikt, waarbij hij de voor- en nadelen kent..
Waar te vinden en te verkrijgen

Silicium is het zevende meest voorkomende element in het heelal, en het tweede in de aardkorst, en verrijkt ook de aardmantel met zijn enorme familie van mineralen. Dit element associeert zich buitengewoon goed met zuurstof en vormt een breed scala aan oxiden; onder hen, silica, SOtwee, en silicaten (van diverse chemische samenstelling).
Silica is met het blote oog te zien in woestijnen en stranden, aangezien zand voornamelijk uit SiO bestaattwee. Dit oxide kan op zijn beurt in een paar polymorfen voorkomen, waarvan de meest voorkomende zijn: kwarts, amethist, agaat, cristobaliet, tripoli, coesiet, stishoviet en tridymiet. Bovendien is het te vinden in amorfe vaste stoffen zoals opalen en diatomeeënaarde..
Silicaten zijn daarentegen structureel en chemisch nog rijker. Enkele van de silicaatmineralen zijn: asbest (wit, bruin en blauwachtig), veldspaat, klei, mica's, olivijnen, aluminosilicaten, zeolieten, amfibolen en pyroxenen.
Vrijwel alle gesteenten zijn samengesteld uit silicium en zuurstof, met hun stabiele Si-O-bindingen, en hun silica's en silicaten gemengd met metaaloxiden en anorganische soorten..
-Silica reductie
Het probleem bij het verkrijgen van silicium is het verbreken van de Si-O-binding, waarvoor speciale ovens en een goede reductiestrategie nodig zijn. De grondstof voor dit proces is silica in de vorm van kwarts, dat vooraf wordt vermalen tot een fijn poeder..
Van dit gemalen siliciumdioxide kan ofwel amorf ofwel polykristallijn silicium worden bereid..
Amorf silicium
Op kleine schaal, uitgevoerd in een laboratorium en met de juiste maatregelen, wordt silica gemengd met magnesiumpoeder in een smeltkroes en verbrand in afwezigheid van lucht. De volgende reactie vindt dan plaats:
Jatwee(s) + Mg (s) => 2MgO (s) + Si (s)
Magnesium en zijn oxide worden verwijderd met een verdunde zoutzuuroplossing. Vervolgens wordt de overblijvende vaste stof behandeld met fluorwaterstofzuur, zodat het SiO stopt met reagerentwee teveel; anders bevordert de overmaat magnesium de vorming van zijn respectievelijke silicide, MgtweeJa, ongewenste verbinding voor het proces.
De SiOtwee wordt het vluchtige gas SiF4, die wordt teruggewonnen voor andere chemische syntheses. Ten slotte wordt de amorfe siliciummassa gedroogd onder een stroom waterstofgas..
Een andere vergelijkbare methode om amorf silicium te verkrijgen, is door hetzelfde SiF te gebruiken4 eerder geproduceerd, of de SiCl4 (eerder gekocht). De dampen van deze siliciumhalogeniden worden in een inerte atmosfeer over vloeibaar natrium geleid, zodat de reductie van het gas kan plaatsvinden zonder aanwezigheid van zuurstof:
SiCl4(g) + 4Na (l) => Si (s) + 4NaCl (l)
Interessant is dat amorf silicium wordt gebruikt om energiezuinige zonnepanelen te maken.
Kristallijn silicium
Opnieuw beginnend met het verpulverde silica of kwarts, worden ze naar een vlamboogoven gebracht, waar ze reageren met cokes. Op deze manier is het reductiemiddel niet langer een metaal maar een koolstofhoudend materiaal met een hoge zuiverheid:
Jatwee(s) + 2C (s) => Si (s) + 2CO (g)
De reactie produceert ook siliciumcarbide, SiC, dat wordt geneutraliseerd met een overmaat SiOtwee (opnieuw is het kwarts in overmaat):
2SiC (s) + SiOtwee(s) => 3Si (s) + 2CO (g)
Een andere methode om kristallijn silicium te bereiden, is door aluminium als reductiemiddel te gebruiken:
3JAtwee(s) + 4Al (l) => 3Si (s) + 2AltweeOF3(s)
En uitgaande van het kaliumhexafluorurosilicaatzout, Ktwee[SiF6], reageert het ook met metallisch aluminium of kalium om hetzelfde product te produceren:
Ktwee[SiF6] (l) + 4Al (l) => 3Si (s) + 6KF (l) + 4AlF3(g)
Silicium lost onmiddellijk op in gesmolten aluminium, en wanneer het systeem wordt afgekoeld, kristalliseert het eerste en scheidt zich van het tweede; dat wil zeggen, er worden siliciumkristallen gevormd die grijsachtige kleuren lijken.
Polykristallijn silicium
In tegenstelling tot de andere syntheses of producties, begint men om polykristallijn silicium te verkrijgen met een silaangasfase, SiH4. Dit gas wordt onderworpen aan een pyrolyse boven 500 ºC, zodanig dat er een thermische ontleding optreedt en zo, vanaf de aanvankelijke dampen, polykristallen van silicium afgezet worden op een halfgeleideroppervlak..
De volgende chemische vergelijking illustreert de reactie die plaatsvindt:
Ja H4(g) => Si (s) + Htwee(g)
Het is duidelijk dat er geen zuurstof in de kamer zou moeten zijn, omdat deze zou reageren met het SiH4
Ja H4(g) + 2Otwee(g) => SiOtwee(s) + 2HtweeO (g)
En zo is de spontaniteit van de verbrandingsreactie dat deze snel plaatsvindt bij kamertemperatuur met minimale blootstelling van het silaan aan lucht..
Een andere synthetische route om dit type silicium te produceren, gaat uit van kristallijn silicium als grondstof. Ze laten het reageren met waterstofchloride bij een temperatuur rond de 300 ºC, zodat er trichloorsilaan ontstaat:
Si (s) + 3HCl (g) => SiCl3H (g) + Htwee(g)
En de SiCl3H reageert bij 1100 ºC om het silicium te regenereren, maar nu polykristallijn:
4SiCl3H (g) => Si (s) + 3SiCl4(g) + 2Htwee(g)
Kijk maar naar de vergelijkingen om een idee te krijgen van het werk en de strenge productieparameters waarmee rekening moet worden gehouden..
Isotopen
Silicium komt van nature voor en vooral als isotoop 28Ja, met een overvloed van 92,23%.
Daarnaast zijn er nog twee andere isotopen die stabiel zijn en daarom geen radioactief verval ondergaan: 29Ja, met een overvloed van 4,67%; Y 30Ja, met een overvloed van 3,10%. Omdat het zo overvloedig is 28Ja, het is niet verwonderlijk dat het atoomgewicht van silicium 28,084 u is.
Silicium is ook te vinden in verschillende radio-isotopen, waaronder de 31Ja (t1/2= 2,62 uur) en 32Ja (t1/2= 153 jaar). Anderen (22Ja - 44Als ze hebben t1/2 heel kort of kort (minder dan honderdsten van een seconde).
Risico's
Zuiver silicium is een relatief inerte stof, dus het hoopt zich gewoonlijk niet op in een orgaan of weefsel zolang de blootstelling eraan laag is. In poedervorm kan het de ogen irriteren, tranen of roodheid veroorzaken, terwijl het aanraken huidongemakken, jeuk en afschilfering kan veroorzaken..
Bij een zeer hoge blootstelling kan silicium de longen beschadigen; maar zonder nawerking, tenzij de hoeveelheid voldoende is om verstikking te veroorzaken. Dit is echter niet het geval bij kwarts, dat wordt geassocieerd met longkanker en ziekten zoals bronchitis en emfyseem..
Evenzo is puur silicium zeer zeldzaam in de natuur en zijn verbindingen, zo overvloedig aanwezig in de aardkorst, vormen geen enkel risico voor het milieu..
Nu, met betrekking tot organosilicium: deze kunnen giftig zijn; Maar aangezien er veel zijn, hangt het ervan af welke wordt overwogen, evenals andere factoren (reactiviteit, pH, werkingsmechanisme, enz.).
Toepassingen
Bouwindustrie
Siliciummineralen vormen de "steen" waarmee gebouwen, huizen of monumenten worden gebouwd. Zo bestaan cement, beton, stucwerk en vuurvaste stenen uit vaste mengsels op basis van silicaten. Vanuit deze benadering kan men zich het nut van dit element in steden en in architectuur voorstellen..
Glas en keramiek
Kristallen die in optische apparaten worden gebruikt, kunnen van silica worden gemaakt, of het nu gaat om isolatoren, monstercellen, spectrofotometers, piëzo-elektrische kristallen of louter lenzen..
Evenzo, wanneer het materiaal wordt bereid met meerdere toevoegingen, verandert het in een amorfe vaste stof, ook wel bekend als glas; en bergen zand zijn gewoonlijk de bron van het silica of kwarts dat nodig is voor de productie ervan. Aan de andere kant worden met silicaten keramische materialen en porselein vervaardigd.
Door ideeën met elkaar te verweven, is silicium ook aanwezig in ambachten en versieringen.
Legeringen
Siliciumatomen kunnen samensmelten en mengbaar zijn met een metalen matrix, waardoor het een additief wordt voor veel legeringen of metalen; bijvoorbeeld staal om magnetische kernen te maken; bronzen, voor de vervaardiging van telefoonkabels; en aluminium, bij de productie van de aluminium-siliciumlegering die bestemd is voor lichte auto-onderdelen.
Daarom is het niet alleen terug te vinden in de "steen" van gebouwen, maar ook in de metalen van hun kolommen..
Droogmiddelen

Siliciumdioxide, in gel- of amorfe vorm, maakt het mogelijk om vaste stoffen te vervaardigen die als droogmiddel werken door de watermoleculen die de container binnenkomen op te sluiten en de binnenkant droog te houden..
Elektronische industrie

Siliciumlagen van verschillende diktes en kleuren maken deel uit van computerchips, omdat met hun vaste (kristallijne of amorfe) geïntegreerde schakelingen en zonnecellen zijn ontworpen.
Omdat het een halfgeleider is, bevat het atomen met minder (Al, B, Ga) of meer elektronen (P, As, Sb) om het om te zetten in halfgeleiders van het type p of n, respectievelijk. Met de kruispunten van twee siliconen, één n en de andere p, lichtgevende diodes worden vervaardigd.
Siliconen polymeren
De beroemde siliconenlijm bestaat uit een organisch polymeer dat wordt ondersteund door de stabiliteit van de ketens van Si-O-Si-bindingen ... Als deze ketens erg lang, kort of verknoopt zijn, veranderen de eigenschappen van het siliconenpolymeer, evenals hun laatste aanvragen..
Onder de toepassingen, die hieronder worden vermeld, kunnen de volgende worden genoemd:
-Lijmen of lijmen, niet alleen om papier te verbinden, maar ook bouwstenen, rubbers, glaspanelen, stenen, enz..
-Smeermiddelen in hydraulische remsystemen
-Versterkt verven en verbetert de helderheid en intensiteit van hun kleuren, terwijl ze temperatuurveranderingen kunnen weerstaan zonder te barsten of weg te vreten.
-Ze worden gebruikt als waterafstotende sprays, die sommige oppervlakken of voorwerpen droog houden
-Ze geven producten voor persoonlijke hygiëne (tandpasta's, shampoos, gels, scheerschuim enz.) Het gevoel zijdezacht te zijn
-De coatings beschermen de elektronische componenten van kwetsbare apparaten, zoals microprocessors, tegen hitte en vocht
-Met siliconenpolymeren zijn verschillende van de rubberen ballen gemaakt die stuiteren zodra ze op de grond vallen..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Silicium. Hersteld van: en.wikipedia.org
- MicroChemicals. (s.f.). Kristallografie van silicium. Hersteld van: microchemicals.com
- Lenntech B.V. (2019). Periodiek systeem: silicium. Hersteld van: lenntech.com
- Markies Miguel. (s.f.). Silicium voorkomen. Hersteld van: nautilus.fis.uc.pt
- Meer Hemant. (5 november 2017). Silicium. Hersteld van: hemantmore.org.in
- Pilgaard Michael. (22 augustus 2018). Silicium: voorkomen, isolatie en synthese. Hersteld van: pilgaardelements.com
- Dr. Doug Stewart. (2019). Silicon Element Feiten. Chemicool. Hersteld van: chemicool.com
- Christiana Honsberg en Stuart Bowden. (2019). Een verzameling bronnen voor de fotovoltaïsche opvoeder. PVeducatie. Hersteld van: pveducation.org
- American Chemistry Council, Inc. (2019). Siliconen in het dagelijks leven. Hersteld van: sehsc.americanchemistry.com



Niemand heeft nog op dit artikel gereageerd.