
Thermodynamische systeemeigenschappen, typen, voorbeelden

EEN thermodynamisch systeem of werkende substantie is een deel van het universum dat gekozen is om bestudeerd te worden door middel van thermodynamica. Dit is een zeer brede definitie, omdat een thermodynamisch systeem zo groot kan zijn als een melkwegstelsel of het kan een kleine hoeveelheid gas zijn die zich in een cilinder bevindt..
Alles dat het thermodynamische systeem omringt, inclusief massa en ruimte, is zijn omgeving of omgeving. Het gaat niet om de rest van het universum, maar alleen om de omgeving die het systeem kan beïnvloeden.
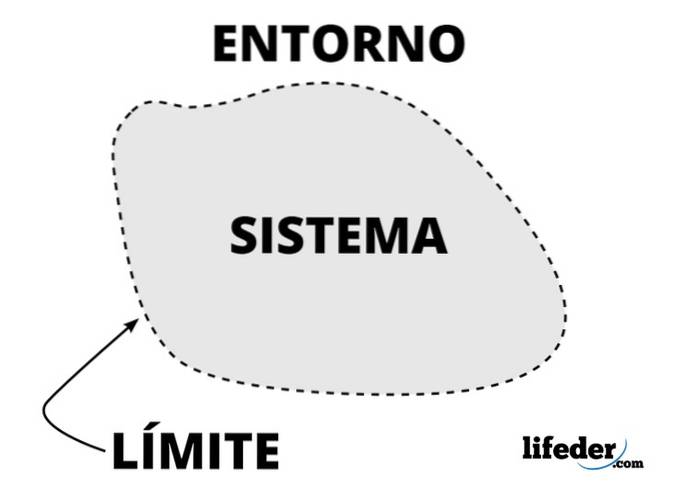
In een thermodynamisch systeem is de uitwisseling van massa of energie tussen het systeem en de omgeving mogelijk, afhankelijk van het soort systeem, namelijk de omgeving waar de waarnemers die het bestuderen zich bevinden.
Bij de analyse van een thermodynamisch systeem is het belangrijk om de grenzen (grenzen of muren), die vast of mobiel kunnen zijn. Een glazen of metalen pot heeft vaste wanden, maar een zuiger of zuiger heeft beweegbare wanden..
Als zodanig kan de grens een reëel of denkbeeldig oppervlak zijn, maar idealiter heeft deze een dikte nul, enige stijfheid en andere kenmerken die wiskundig worden beschreven..
Denkbeeldige grenzen zijn nodig bij het bestuderen van systemen die zelf deel uitmaken van veel grotere systemen, zoals een ster in een nevel..
Warmte-uitwisseling tussen het systeem en zijn omgeving, indien aanwezig, zijn de primaire doelen van thermodynamica. Daarom wordt een speciale naam gegeven aan de muren die uitwisseling mogelijk maken: adiabatisch, terwijl degenen die dit niet toestaan en het systeem isoleren diathermisch zijn..
Artikel index
- 1 Soorten thermodynamische systemen
- 1.1 Open systemen
- 1.2 Gesloten systemen
- 1.3 Geïsoleerde systemen
- 1.4 Homogene systemen en heterogene systemen
- 2 Voorbeelden van thermodynamische systemen
- 2.1 Container ondergedompeld in water
- 2.2 Koken in een onbedekte pan
- 2.3 Verbrandingsmotor
- 2.4 Koffie of thee in een thermoskan
- 2,5 Eieren
- 2.6 Cellen
- 2.7 Ingeblikt
- 2.8 Boiler
- 3 referenties
Soorten thermodynamische systemen
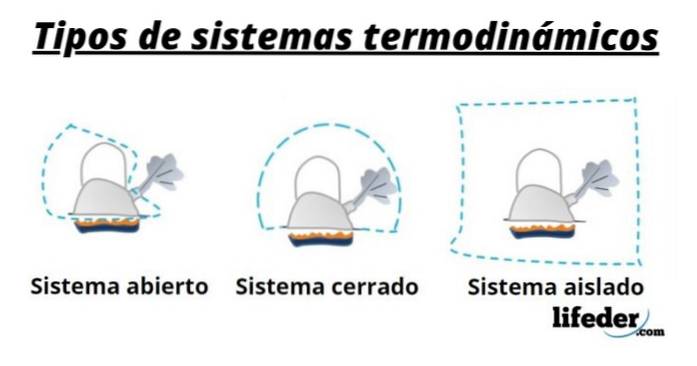
Er zijn verschillende soorten thermodynamische systemen, die zijn geclassificeerd op basis van hun vermogen om materie en energie uit te wisselen met de omgeving, op deze manier hebben we:
Open systemen
De uitwisseling van materie en energie met de buitenwereld is toegestaan, daarom worden ze ook wel genoemd volume regelen.
Veel systemen in de techniek worden op deze manier gemodelleerd, bijvoorbeeld waterverwarmers voor thuis en autoradiatoren..
Gesloten systemen
Ze worden ook wel controlemassa genoemd en worden gekenmerkt doordat er geen uitwisseling van materie met de omgeving plaatsvindt. Daarom is zijn massa vast, maar energie kan zijn limiet overschrijden, hetzij als warmte of als werk. Op deze manier kan het volume van het systeem variëren.
Geïsoleerde systemen
Dit zijn gesloten systemen waarbij uitwisseling van warmte, arbeid of enige vorm van energie met de omgeving wordt voorkomen.
Homogene systemen en heterogene systemen
De beschreven systemen zijn geclassificeerd op basis van hun vermogen tot uitwisseling met de omgeving, maar dit is niet het enige criterium. Thermodynamische systemen kunnen ook homogeen en heterogeen zijn.
Zuivere stoffen zijn goede voorbeelden van homogene systemen, zoals keukenzout opgeslagen in de zoutvaatje. Integendeel, een combinatie van vloeibaar water en waterdamp is een heterogeen systeem, omdat het om twee verschillende toestanden gaat, waarvan de eigenschappen verschillen.
Voorbeelden van thermodynamische systemen
Zoals we hebben gezien, variëren thermodynamische systemen van de eenvoudigste tot de meest complexe. Bij het bestuderen ervan is het echter handig om ze zorgvuldig te definiëren en alle manieren te vinden om de analyse te vereenvoudigen..
Laten we eens kijken naar enkele voorbeelden van echte systemen die ons in het dagelijks leven vergezellen:
Container ondergedompeld in water

Dit is een heel eenvoudig en illustratief thermodynamisch systeem, en ook een goede manier om voedsel te bereiden. De inhoud van de container, of het nu eieren zijn, een mengsel voor een vlaai of wat voor bereiding dan ook, is het thermodynamische systeem, terwijl het waterbad de omgeving of omgeving vormt..
Bij het verwarmen van het water stroomt de warmte via de rand van de container in het systeem.
Hoe snel het voedsel kookt, hangt af van verschillende factoren, waaronder het materiaal van de pan: of het keramiek of metaal is. We weten dat metaal een goede warmtegeleider is, dus we verwachten dat de inhoud snel opwarmt als een stalen of aluminium pot wordt gebruikt..
In plaats van het systeem te verwarmen, wilt u misschien afkoelen, bijvoorbeeld een fles babymelk verwarmen die oververhit is geraakt. In dit geval geeft het systeem warmte af aan het waterbad.
Koken in een onbedekte koekenpan

De keuken is een uitstekende plek om thermodynamische processen te ontdekken. Een saus, kip of ander voedsel gekookt in een open koekenpan is een voorbeeld van een open systeem, aangezien daar allerlei uitwisseling met de omgeving is toegestaan: kruiden, andere ingrediënten toevoegen en de warmte die wordt toegevoegd aanpassen.
Verbrandingsmotor
In de verbrandingsmotor van auto's, motorfietsen, vliegtuigen en boten is er een mengsel van gas (lucht) en brandstof dat in de carburateur wordt bereid en naar de cilinder wordt gevoerd, waar het door verbranding een mengsel van verschillende gassen wordt.
Aangezien de samenstelling van het mengsel tijdens de werkcyclus varieert, is het een complex en heterogeen thermodynamisch systeem.
Koffie of thee in een thermoskan

Koffie of thee blijft langer warm in een thermoskan. Het is een bak met isolerende wanden, juist om te voorkomen dat ons systeem - de warme drank - zijn warmte afgeeft aan de omgeving en afkoelt..
Eigenlijk zijn een thermoskan twee containers, waartussen een gedeeltelijk vacuüm wordt gemaakt om de aanwezigheid van een medium zoals lucht te vermijden, dat helpt bij het geleiden van warmte van de binnenkant naar de buitenkant van de container..
Uiteraard werkt de thermoskan ook omgekeerd, hij dient om dranken langer koud te houden.
Eieren
De eieren die we consumeren als voedsel zijn uitstekende voorbeelden van gesloten thermodynamische systemen, maar ze maken de uitwisseling van energie met de omgeving mogelijk. De eierschaal laat de warmte van de hen toe om het embryo uit te laten komen, evenals de doorgang van gassen.
Cellen
De cel is de fundamentele eenheid van levende wezens en is een wonderbaarlijk efficiënt thermodynamisch systeem. Bij uitbreiding kan elk levend wezen ook worden beschouwd als een complex thermodynamisch systeem.
Het celmembraan dat interne structuren zoals de kern en mitochondriën bekleedt, is de grens tussen het systeem en de omgeving. Dit maakt energie-uitwisseling mogelijk, de aanvoer van voedingsstoffen van buitenaf en het afvoeren van afvalstoffen.
Ingeblikt
Ingeblikt voedsel zijn typische voorbeelden van gesloten thermodynamische systemen.
Waterkoker
Het water in de kachel is een open thermodynamisch systeem, aangezien het nodig is om warmte het water te laten bereiken, meestal van een elektrische weerstand die wordt verwarmd, als de kachel elektrisch is, of door zonne-energie of de vlam die afkomstig is van een aansteker. gas-.
Referenties
- Borgnakke. 2009. Grondbeginselen van de thermodynamica. 7e editie. Wiley and Sons.
- Cengel, Y. 2012. Thermodynamica. 7e editie. Mcgraw heuvel.
- Zonne energie. Thermodynamische systemen. Hersteld van: solar-energy.net.
- Wikipedia. Thermodynamische systemen. Hersteld van: es.wikipedia.org.
- Wikipedia. Thermodynamisch systeem. Opgehaald van en.wikipedia.org.



Niemand heeft nog op dit artikel gereageerd.