
Chroom (III) oxide structuur, nomenclatuur, eigenschappen, gebruik
De chroom (III) oxide Chroomoxide is een groene anorganische vaste stof die wordt gevormd door het verbranden van chroommetaal (Cr) in zuurstof (Otwee), waardoor het chroom een oxidatietoestand van 3+ heeft. De chemische formule is CrtweeOF3. In de natuur komt het voor in het mineraal Eskolaíta. Er zijn geen bruikbare natuurlijke afzettingen van chroom (III) oxide bekend.
Het kan onder andere worden bereid door Cr te verwarmentweeOF3 gehydrateerd (CrtweeOF3.nHtweeO) om het water volledig te verwijderen. Het wordt ook verkregen als een product van de calcinering van chroom (VI) oxide (CrO3.

De beste manier om het puur te krijgen, is door ontleding van ammoniumdichromaat (NH4tweeCrtweeOF7 bij 200 ° C. Industrieel wordt geproduceerd door reductie van natriumdichromaat (NatweeCrtweeOF7) vast met zwavel.
Als het fijn verdeeld is, heeft het een heldergroene kleur met een gelige tint. Maar als de deeltjes groter zijn, vertoont het een blauwachtige tint. Chroomoxide is het meest stabiele groene pigment dat bekend is. Door zijn thermische en chemische bestendigheid is het een waardevolle keramische kleurstof.
Het wordt onder meer gebruikt in industriële coatings, vernissen, in de bouw, in sieraden, als kleurstof in cosmetica of in farmaceutische producten..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3,2 Mohs-hardheid
- 3.3 Molecuulgewicht
- 3.4 Smeltpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3,7 pH
- 3.8 Brekingsindex
- 3.9 Overige eigenschappen
- 4 toepassingen
- 4.1 In de keramiek- en glasindustrie
- 4.2 In industriële coatings
- 4.3 In de vuurvaste industrie
- 4.4 In aanbouw
- 4.5 Als pigment in verschillende toepassingen
- 4.6 In sieraden
- 4.7 Bij katalyse van chemische reacties
- 4.8 Bij de vervaardiging van chroom
- 4.9 Op magnetische materialen
- 4.10 Recente innovaties
- 5 referenties
Structuur
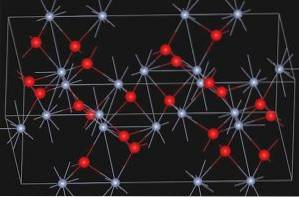
Α-Cr-oxidetweeOF3 Het heeft de structuur van het korundtype. Het kristalsysteem is hexagonaal rhombohedraal. Het is isomorf met α-aluminiumoxide en α-FetweeOF3.
Eskolaiet, een natuurlijk mineraal van chroom (III) oxide, heeft de onderstaande structuur:
Nomenclatuur
- Chroom (III) oxide.
- Chroomoxide groen.
- Dichroomtrioxide.
- Chroom-sesquioxide.
- Chromia.
- Eskolaíta: Chroom (III) oxide mineraal.
- Hydrateren: CrtweeOF3.nHtweeO (waarbij n ≅ 2) wordt Chromium (III) Oxide Hydrate of Guignet Green genoemd.

Eigendommen
Fysieke toestand
Kristallijne vaste stof.
Mohs-hardheid
9 (de kristallen zijn extreem hard).
Molecuulgewicht
151,99 g / mol.
Smeltpunt
Het smelt bij 2435 ° C, maar begint te verdampen bij 2000 ° C en vormt wolken van groene rook..
Dichtheid
5,22 g / cm3
Oplosbaarheid
Als het tot hoge temperaturen is verhit, is het praktisch onoplosbaar in water (3 microgram / l bij 20 ° C); onoplosbaar in alcoholen en aceton; slecht oplosbaar in zuren en logen; sOplosbaar in perchloorzuur (HClO4) tot 70%, waarin het uiteenvalt.
pH
6.
Brekingsindex
2551.
Andere eigenschappen
- Als het sterk wordt gecalcineerd, wordt het inert voor zuren en basen. Anders is de CrtweeOF3 en zijn gehydrateerde vorm CrtweeOF3.nHtweeOf ze zijn amfoteer en lossen gemakkelijk op in zuur om aqua-ionen te geven [Cr (HtweeOF)63+, en in geconcentreerde alkali om ‘chromieten’ te vormen.
- Wanneer het gecalcineerd is, is het chemisch resistent tegen zuren, logen en hoge temperaturen. Het is extreem stabiel voor SOtwee.
- Het heeft een uitstekende weerstand tegen licht vanwege het feit dat de kristallen opaciteit, hoge UV-demping en transparantie voor zichtbaar licht hebben..
- Het is een extreem hard materiaal dat kwarts, topaas en zirkonium kan krassen.
- Het hydrateert CrtweeOF3.nHtweeO (waarbij n ≅ 2) geen thermische stabiliteit heeft, beperkt zijn hydratatiewater zijn toepasbaarheid tot minder dan 260 ºC. Lage aanverfbaarheid en beperkt kleurengamma.
- Maar dit hydraat heeft een zeer schone en heldere blauwgroene tint. Het is semi-transparant, vertoont een lage opaciteit, uitstekende lichtechtheid en alkalibestendigheid.
- De crtweeOF3 Het is niet geclassificeerd als gevaarlijk materiaal en wordt beschouwd als een inert fijn poeder. Het is niet onderworpen aan internationale transportvoorschriften.
- Het irriteert de huid of slijmvliezen niet.
Toepassingen
In de keramiek- en glasindustrie
Vanwege de hoge hittebestendigheid en chemische bestendigheid, CrtweeOF3 gecalcineerd wordt gebruikt als kleurstof of verglaasbaar pigment bij de vervaardiging van keramiek, in porseleinemail en glasmengsels.
In industriële coatings
Chroom (III) oxide keramiek biedt uitstekende weerstand tegen de meeste corrosieve omgevingen. Dit alles door het mechanisme van uitsluiting van het substraat van de omgeving eromheen..
Om deze reden wordt het gebruikt in coatings om corrosie van veel materialen te voorkomen, doordat het wordt aangebracht door middel van thermisch spuiten (verneveling of hete spray)..
Het wordt ook gebruikt als bescherming tegen schurende slijtage (wanneer materiaalverwijdering wordt veroorzaakt door deeltjes die over een oppervlak bewegen).
In deze gevallen is het aanbrengen van een coating van CrtweeOF3 door plasma-afzetting, genereert een hoge slijtvastheid.
De twee voorgaande cases zijn bijvoorbeeld bruikbaar bij gasturbinemotoren in de lucht- en ruimtevaartindustrie..
In de vuurvaste industrie
Gebruikt bij de productie van thermisch en chemisch bestendige bakstenen, bekledingsmaterialen en vuurvast beton op basis van aluminiumoxide.
In aanbouw
Omdat het uitermate goed bestand is tegen atmosferische omstandigheden, licht en hitte, wordt het toegepast als gesteentekorrels kleurstof voor asfaltdaken, betoncement, hoogwaardige industriële coatings voor buiten, staalconstructies en gevelcoatings (emulgeerbare verven)..
Als pigment in verschillende toepassingen
Het is bestand tegen vulkanisatieomstandigheden en wordt niet afgebroken, daarom wordt het gebruikt bij rubberpigmentatie.
Omdat het niet giftig is, wordt het gebruikt als pigment voor speelgoed, cosmetica (vooral het hydraat), plastic, drukinkten, verven die in contact komen met voedsel en farmaceutische producten.
In de pigmentindustrie wordt het gebruikt als grondstof voor de productie van penetrerende kleurstoffen die chroom bevatten en in pigmenten op basis van gemengde metaaloxidefasen. Het wordt ook gebruikt als verfkleurstof voor coil-coating.
Het hydraat heeft een transparantie die de formulering van polychrome afwerkingen in de auto-industrie mogelijk maakt (metalen afwerkingen van auto's).
Vanwege zijn unieke eigenschap om infraroodstraling (IR) op een vergelijkbare manier te reflecteren als chlorofyl in planten, lijkt het onder infrarood licht op gebladerte. Om deze reden wordt het veel gebruikt in camouflagelakken of coatings voor militaire toepassingen..
In sieraden
Het wordt gebruikt als kleurstof voor synthetische edelstenen. Wanneer Cr wordt geïntroduceerdtweeOF3 als een onzuiverheid in het kristalrooster van α-AltweeOF3, net als bij het halfedelsteenmineraal robijn is de kleur rood in plaats van groen.
Het wordt ook gebruikt als slijp- en polijstmiddel vanwege zijn hoge hardheid en schurende eigenschappen..
Bij katalyse van chemische reacties
Ondersteund in aluminiumoxide (AltweeOF3) of andere oxiden, wordt het in de organische chemie als katalysator gebruikt, bijvoorbeeld bij de hydrogenering van esters of aldehyden om alcoholen te vormen en bij de cyclisatie van koolwaterstoffen. Katalyseert de stikstofreactie (N.twee) met waterstof (H.twee) om ammoniak (NH3.
Vanwege zijn oxidatiereducerende capaciteit, samen met chroom (VI) oxide, speelt het een belangrijke rol bij de dehydrogenering van alkanen met CO.twee om propeen en isobuteen te produceren, aangezien de deactivatie-reactivatiecyclus van de katalysator gemakkelijk uitvoerbaar is. Het wordt ook gebruikt als katalysator in anorganische chemie.
Bij de fabricage van chroom
Het wordt gebruikt bij de aluminotherme productie van zuiver chroommetaal. Hiervoor moet het worden verwarmd tot 1000 ºC om de korrelgrootte te vergroten..

Op magnetische materialen
Het is in kleine hoeveelheden toegevoegd aan magnetische materialen in audio- en videobanden, waardoor de geluidskoppen een zelfreinigend effect hebben..
Recente innovaties
Pigmenten met een verbeterde bijna-IR-reflectie zijn verkregen door Cr-nanodeeltjes te doterentweeOF3 met zouten van elementen die tot de groep van zeldzame aarden behoren, zoals lanthaan en praseodymium.
Door de concentratie van deze elementen te verhogen, neemt de nabij-infrarode zonnereflectie toe zonder de groene kleur van het Cr-pigment aan te tasten.tweeOF3.
Dit maakt CrtweeOF3 gedoteerd als "koud" pigment, omdat het geschikt is om de warmteontwikkeling te beheersen.
Toegepast op onder meer plafonds, auto's en stoffering, bereikt het een hoge reflectie van IR-zonlicht, waardoor de toename van warmte in de omgeving aanzienlijk kan worden verminderd.
Referenties
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Deel 19. Vierde editie. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Vijfde editie. Deel A7 en A20. VCH Verlagsgesellschaft mbH.
- Amerikaanse elementen. (2019). Chroom (III) oxide. Opgehaald van americanelements.com.
- Nationale bibliotheek van geneeskunde. (2019). Chroom (III) oxide. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Dorfman, Mitchell R. (2012). Thermische sproeibekledingen. In Handbook of Environmental Degradation of Materials. Hoofdstuk 19. Hersteld van sciencedirect.com.
- Takehira, K. et al. (2004). COtwee Dehydrogenering van propaan over Cr-MCM-41-katalysator. In Studies in Surface Science and Catalysis 153. Hersteld van sciencedirect.com.
- Selvam Sangeetha et al. (2012). Functionele pigmenten van chroom (III) oxide nanodeeltjes. Kleurstoffen en pigmenten 94 (2012) 548-552. Opgehaald van sciencedirect.com.


Niemand heeft nog op dit artikel gereageerd.