
Kristallijne vaste stoffen structuur, eigenschappen, typen, voorbeelden

De kristallijne vaste stoffen Het zijn die waarvan de microscopische structuren geordend zijn en een onderscheidend patroon volgen voor een bepaald kristalrooster; bijvoorbeeld: kubisch, zeshoekig, triklien, rhombohedraal, onder anderen.
Deze vaste stoffen zouden bestaan als kristallen, met facetten en geometrische ontwerpen die weerspiegelen hoe ordelijk ze van binnen zijn. Andere voorbeelden van kristallijne vaste stoffen zijn diamant, kwarts, antraceen, droogijs, kaliumchloride of magnesiumoxide..

Een bekend paar kristallijne vaste stoffen is dat van suiker en zout (NaCl). Op het eerste gezicht vertonen beide witte kristallen; maar hun eigenschappen verschillen enorm. Suiker is een moleculair kristallijne vaste stof, terwijl zout een ionische kristallijne vaste stof is. De eerste bestaat uit sucrosemoleculen; en de tweede, van Na-ionen+ en Cl-.
De afbeelding hierboven geeft een glimp van hoe helder suikerkristallen kunnen zijn. De zoutkristallen blijven echter niet ver achter. Hoewel suiker en zout broers lijken, zijn hun structuren verschillend: suiker, dat is sucrose, heeft een monokliene structuur; terwijl zout, een kubieke structuur.
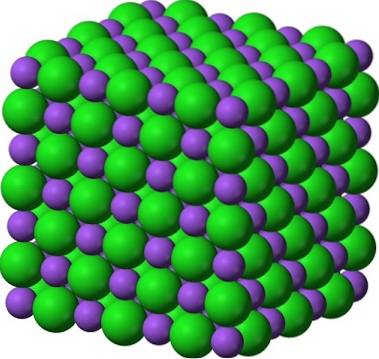
Poedersuiker en zout (glazuur) blijven kristallijn; zijn kristallen zijn alleen zo veel kleiner geworden voor onze ogen. De kristalliniteit van een vaste stof wordt daarom meer bepaald door zijn interne structuur dan door zijn uiterlijk of helderheid..
Artikel index
- 1 Structuur van kristallijne vaste stoffen
- 2 Eigenschappen
- 3 soorten kristallijne vaste stoffen
- 3.1 Ionisch
- 3.2 Metaalachtig
- 3.3 Moleculair
- 3.4 Covalente netwerken
- 4 voorbeelden
- 4.1 Ionisch
- 4.2 Metaalachtig
- 4.3 Moleculair
- 4.4 Covalente netwerken
- 5 referenties
Structuur van kristallijne vaste stoffen
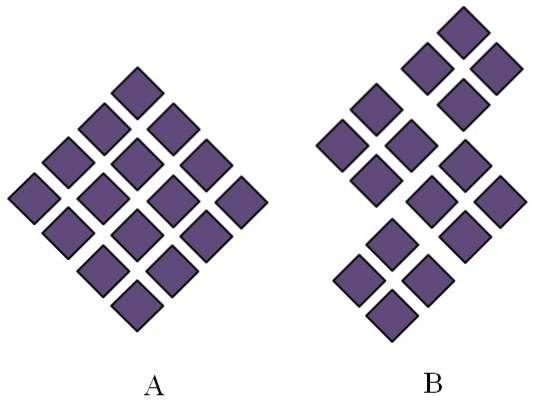
Kristallijne vaste stoffen hebben geordende structuren. Hun geometrische kenmerken zullen afhangen van het type kristallijn rooster waartoe ze behoren, dat op zijn beurt extern wordt geprojecteerd in de vormen van het kristal (kristallijn systeem). De afbeelding hierboven illustreert twee belangrijke concepten van dergelijke structuren: periodiciteit en kristallijne korrels..
De ruimtelijke ordening van de deeltjes van een kristallijne vaste stof is periodiek; dat wil zeggen, het herhaalt zich keer op keer in alle richtingen. Dit creëert zijn eigen structurele patroon voor elk massief en kristalrooster; dit is bijvoorbeeld waar zout en suiker zich beginnen te differentiëren buiten hun chemische aard.
In A zijn de ruiten zo gerangschikt dat ze aanleiding geven tot een grotere ruit. Elke paarse ruit vertegenwoordigt een deeltje of een reeks deeltjes (atomen, ionen of moleculen). Aldus kan worden verwacht dat een macroscopisch kristal van A een rhombohedraal uiterlijk heeft..
Ondertussen zijn in B de ruiten zo gerangschikt dat ze kristallijne korrels doen ontstaan; dit zijn zeer kleine kristallen (kristallieten). B wordt dan een polykristallijne vaste stof genoemd; dat wil zeggen, het wordt gevormd door de agglomeratie van meerdere kristallieten.
Concluderend kan een vaste stof eenvoudig kristallijn (A) of polykristallijn (B) zijn; A vormt kristallen, terwijl B polykristallen.
Eigendommen
De eigenschappen van kristallijne vaste stoffen zijn afhankelijk van het type kristal. Het is al bekend dat hun structuren ordelijk zijn en dat ze ook de neiging hebben om heldere kenmerken te vertonen waar mineraalliefhebbers verliefd op worden. Er werd echter vermeld dat een poedervormige vaste stof, zelfs "uit", ook als kristallijn kan worden geclassificeerd..
De manier waarop hun deeltjes ruimtelijk georiënteerd zijn, stelt hen in staat om enkele belangrijke eigenschappen te hebben voor hun karakterisering. Kristallijne vaste stoffen zijn bijvoorbeeld in staat tot diffractie van röntgenstralen, waardoor diffractiespectra worden gecreëerd waaruit de microscopische structuur van een kristal kan worden bepaald..
Omdat de structuur periodiek is, verspreidt de warmte zich op dezelfde manier door de vaste stof; zolang er geen onzuiverheden bij betrokken zijn. De smeltpunten voor een kristallijne vaste stof zijn dus constant en variëren niet, ongeacht hoe ze worden gemeten..
Soorten kristallijne vaste stoffen
De soorten kristallijne vaste stoffen zijn gebaseerd op het type deeltjes waaruit ze zijn gemaakt en wat hun interacties of bindingen zijn. Er zijn in wezen vier typen: ionische, metallische, moleculaire en covalente netwerken.
Zelfs als ze een bepaalde mate van onzuiverheden vertonen, blijven ze kristallijn, ook al zijn hun eigenschappen aangetast en vertonen ze niet dezelfde waarden die worden verwacht voor een zuivere vaste stof..
Ionics
Zout is een voorbeeld van een ionische kristallijne vaste stof, aangezien het is samengesteld uit Na-ionen+ en Cl-. Daarom regeert in dit type vaste stoffen de ionische binding: het zijn de elektrostatische krachten die de structurele ordening bepalen..
Metalen
Alle metaalatomen vormen metaalachtige kristallen. Dit betekent dat bijvoorbeeld een zilveren vork een conglomeraat is van versmolten zilverkristallen. De interne of microscopische structuur is hetzelfde in elke handspanwijdte van het object en blijft ongewijzigd vanaf het handvat van de vork tot het puntje van de tanden..
Moleculair
Suiker is een voorbeeld van een moleculair kristallijne vaste stof, omdat het bestaat uit sucrosemoleculen. Daarom bestaat dit type vaste stof uit moleculen, die door hun intermoleculaire interacties (en niet covalente bindingen) erin slagen een geordende structuur tot stand te brengen..
Covalente netwerken
Ten slotte hebben we de kristallijne vaste stoffen van covalente netwerken. Covalente bindingen overheersen daarin, omdat ze verantwoordelijk zijn voor het vestigen van een orde en het sterk gefixeerd houden van de atomen in hun respectieve ruimtelijke posities. We spreken niet van ionen, atomen of moleculen, maar van driedimensionale netwerken.
Voorbeelden
Vervolgens en tot slot zullen enkele voorbeelden worden genoemd voor elk van de soorten kristallijne vaste stoffen.
Ionics
Alle zouten zijn ionische vaste stoffen. Evenzo zijn er sulfiden, hydroxiden, oxiden, halogeniden en andere verbindingen die ook uit ionen bestaan, of hun interacties zijn in wezen ionisch. Dus we hebben:
-KCl
-Geval4
-Ba (OH)twee
-CURSUS4
-FeCl3
-NatweeS
-MgO
-CaFtwee
-NaHCO3
-(NH4tweeCrO4
Naast deze voorbeelden wordt de overgrote meerderheid van de mineralen beschouwd als ionische kristallijne vaste stoffen.
Metalen
Elk metalen element komt van nature voor als metalen kristallen. Sommige ervan zijn:
-Koper
-Ijzer
-Aluminium
-Chrome
-Metallische waterstof (onder onvoorstelbare druk)
-Wolfraam
-Zirkonium
-Titanium
-Magnesium
-Natrium
Moleculair
Er is een grote verscheidenheid aan moleculaire kristallijne vaste stoffen. Vrijwel elke organische verbinding die stolt, kan kristallen vormen als de zuiverheid hoog is of als de structuur niet te ingewikkeld is. Dus we hebben:
-IJs (H.tweeOF)
-Droogijs (COtwee
-iktwee
-P.4
-S8 (en zijn polymorfen)
-Antraceen
-Vaste zuurstof
-Vaste ammoniak
-Fenolftaleïne
-Benzoëzuur
Covalente netwerken
En tot slot hebben we onder enkele kristallijne vaste stoffen van covalente netwerken:
-Diamant
-Grafiet
-Koolstof nanobuisjes
-Fullerenen
-Kwarts
-Silicium
-Germanium
-Boornitride
Uit deze lijst kunnen koolstofnanobuisjes en fullerenen ook worden beschouwd als moleculair kristallijne vaste stoffen. Dit komt omdat, hoewel ze bestaan uit covalent gebonden koolstofatomen, ze eenheden definiëren die kunnen worden gevisualiseerd als macromoleculen (voetballen en buizen)..
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2020). Kristal. Hersteld van: en.wikipedia.org
- Chemie LibreTexts. (16 juni 2019). Kristallijne en amorfe vaste stoffen. Hersteld van: chem.libretexts.org
- Rachel Bernstein en Anthony Carpi. (2020). Eigenschappen van vaste stoffen. Hersteld van: visionlearning.com


Niemand heeft nog op dit artikel gereageerd.