
Geconcentreerde oplossingskenmerken en voorbeelden

EEN Geconcentreerde oplossing Het is er een die een grote hoeveelheid opgeloste stof bevat in verhouding tot de hoeveelheid die het zou kunnen oplossen; terwijl een verdunde oplossing een lage concentratie opgeloste stof heeft. Een verdunde oplossing kan worden bereid uit een geconcentreerde oplossing door er oplosmiddel aan toe te voegen of, indien mogelijk, opgeloste stof eruit te extraheren..
Het concept kan relatief zijn, aangezien wat een geconcentreerde oplossing definieert, hoge waarden zijn in sommige van zijn eigenschappen; Zo heeft een ijs-meringue een hoge suikerconcentratie, wat wordt bewezen door zijn zoete smaak.
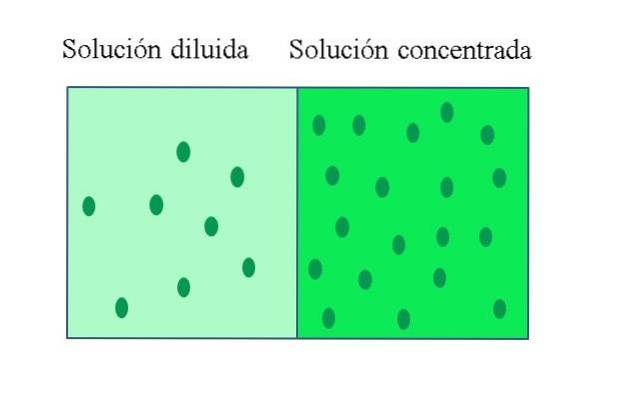
De opgeloste stofconcentratie van een geconcentreerde oplossing is dichtbij of gelijk aan die van een verzadigde oplossing. Het belangrijkste kenmerk van een verzadigde oplossing is dat deze bij een bepaalde temperatuur geen extra hoeveelheid opgeloste stof kan oplossen. Daarom blijft de concentratie van de opgeloste stof in zijn verzadigde oplossingen constant..
De oplosbaarheid van de meeste opgeloste stoffen neemt toe met toenemende temperatuur. Op deze manier kan een extra hoeveelheid opgeloste stof worden opgelost in een verzadigde oplossing..
Als de temperatuur dan afneemt, wordt de concentratie opgeloste stof van de verzadigde oplossing verhoogd. In dit geval gesproken over een oververzadigde oplossing.
Artikel index
- 1 Kenmerkend voor een geconcentreerde oplossing
- 2 Colligatieve eigenschappen van oplossingen
- 2.1 Osmolariteit en osmolaliteit
- 2.2 Dampdrukverlaging
- 2.3 Afdaling van het cryoscopische punt
- 2.4 Kookpuntverhoging
- 2.5 Osmotische druk
- 3 Verschillen met verdunde oplossing
- 4 Voorbeelden van oplossingen
- 4.1 Geconcentreerd
- 4.2 Verdund
- 5 referenties
Kenmerkend voor een geconcentreerde oplossing
De concentratie van een oplossing, dat wil zeggen de relatie tussen de hoeveelheid opgeloste stof en de hoeveelheid oplossing of oplosmiddel, kan worden uitgedrukt als een percentage van de opgeloste stof in de oplossing (P / V of P / P).
Het kan ook worden uitgedrukt in mol opgeloste stof per liter oplossing (molariteit) en opgeloste equivalenten per liter oplossing (normaliteit).
Evenzo is het gebruikelijk om de concentratie van een oplossing uit te drukken in molen opgeloste stof per kilogram oplosmiddel (molaliteit) of om deze uit te drukken in molen opgeloste stof in verhouding tot het totale aantal molen van de oplossing (molfractie). In verdunde oplossingen is het gebruikelijk om de concentratie van een oplossing te vinden in p.p.m. (delen per miljoen).
Ongeacht de uitdrukkingsvorm van de concentratie van een oplossing, een geconcentreerde oplossing heeft een hoog aandeel van de opgeloste stof, in dit geval uitgedrukt als massa, in verhouding tot de massa of het volume van de oplossing of het oplosmiddel. Deze concentratie is gelijk aan de oplosbaarheid van de opgeloste stof in het oplosmiddel of benadert de waarde ervan..
Colligatieve eigenschappen van oplossingen
Ze zijn een reeks eigenschappen van oplossingen die afhankelijk zijn van het aantal deeltjes in de oplossing, ongeacht hun type.
De colligatieve eigenschappen maken geen onderscheid tussen de eigenschappen van de deeltjes, of het nu gaat om natriumatomen, chlooratomen, glucose enz. Het belangrijkste is uw nummer.
Vanwege dit feit werd het noodzakelijk om een andere manier te creëren om de concentratie van een oplossing uit te drukken die gerelateerd is aan de zogenaamde colligatieve eigenschappen. Als reactie hierop werden de uitdrukkingen osmolariteit en osmolaliteit gecreëerd.
Osmolariteit en osmolaliteit
Osmolariteit is gerelateerd aan de molariteit van de oplossing en osmolaliteit aan de molaliteit ervan..
De eenheden van osmolariteit zijn osm / l oplossing of mosm / l oplossing. Terwijl de eenheden van osmolaliteit osm / kg water of mosm / kg water zijn.
Osmolariteit = mvg
m = molariteit van de oplossing.
v = aantal deeltjes waarin een verbinding dissocieert in waterige oplossing. Bijvoorbeeld: voor NaCl heeft v de waarde 2; voor CaCltwee, v heeft een waarde van 3 en voor glucose, een elektrolytische verbinding die niet dissocieert, heeft v een waarde van 1.
g = osmotische coëfficiënt, correctiefactor voor de interactie van elektrisch geladen deeltjes in oplossing. Deze correctiefactor heeft een waarde dichtbij 1 voor verdunde oplossingen en neigt naar nul naarmate de molariteit van de elektrolytverbinding toeneemt..
De colligatieve eigenschappen worden hieronder vermeld, waarmee kan worden bepaald hoeveel een oplossing is geconcentreerd.
Dampdrukverlaging
Wanneer het water wordt verwarmd, verdampt het en oefent de gevormde stoom een druk uit. Naarmate opgeloste stof wordt toegevoegd, neemt de dampspanning af.
Daarom hebben geconcentreerde oplossingen een lage dampspanning. De verklaring is dat opgeloste moleculen watermoleculen verdringen op het grensvlak water-lucht..
Cryoscopische puntafdaling
Naarmate de osmolariteit van een oplossing toeneemt, neemt de temperatuur waarbij de waterige oplossing bevriest af. Als de vriestemperatuur van zuiver water 0 ° C is, wordt de vriestemperatuur van een geconcentreerde waterige oplossing lager dan die waarde..
Kookpuntverhoging
Volgens de wet van Raoult is de verhoging van het kookpunt van het zuivere oplosmiddel recht evenredig met de molariteit van de oplossing die ontstaat door de toevoeging van opgeloste stof. Daarom hebben geconcentreerde oplossingen een hoger kookpunt dan water..
Osmotische druk
Er zijn twee compartimenten met verschillende concentraties, gescheiden door een membraan dat water doorlaat, maar de doorgang van opgeloste deeltjes beperkt..
Het water stroomt van de oplossing met de laagste concentratie opgeloste stof naar de oplossing met de hoogste concentratie opgeloste stof.
Deze netto waterstroom zal geleidelijk verdwijnen omdat het opgehoopte water in het compartiment met de hoogste concentratie een hydrostatische druk genereert die de waterstroom in dit compartiment tegenwerkt..
De stroming van water door osmose vindt meestal plaats naar geconcentreerde oplossingen.
Verschillen met verdunde oplossing
-Geconcentreerde oplossingen hebben een hoog gehalte aan opgeloste stof in verhouding tot het volume of de massa van de oplossing. Verdunde oplossingen hebben een laag gehalte aan opgeloste stof in verhouding tot het volume of de massa van de oplossing.
-Ze hebben een hogere molariteit, molaliteit en normaliteit dan die van verdunde oplossingen.
-Het vriespunt van geconcentreerde oplossingen is lager dan dat van verdunde oplossingen; dat wil zeggen, ze bevriezen bij koudere temperaturen.
-Een geconcentreerde oplossing heeft een lagere dampdruk dan een verdunde oplossing.
-Geconcentreerde oplossingen hebben een hoger kookpunt dan verdunde oplossingen.
-In contact gebracht via een semi-permeabel membraan, zal het water van de verdunde oplossingen naar de geconcentreerde oplossingen stromen.
Voorbeelden van oplossingen
Geconcentreerd
-Honing is een verzadigde oplossing van suiker. Het is gebruikelijk om het optreden van herkristallisatie van suiker waar te nemen, wat blijkt uit de deksels van de containers die de honing bevatten.
-Zeewater met een hoge concentratie aan verschillende zouten.
-Urine van mensen met ernstige uitdroging.
-Koolzuurhoudend water is een verzadigde oplossing van kooldioxide.
Verdund
-Urine van een persoon met overmatige waterinname.
-Zweet heeft meestal een lage osmolariteit.
-Veel medicijnen die in de vorm van een oplossing worden gegeven, hebben een lage concentratie.
Referenties
- Wikipedia. (2018). Concentratie. Hersteld van: es.wikipedia.org
- Falst L. (2018). Concentratie van oplossingen: definitie en niveaus. Studie. Hersteld van: study.com
- The Chemistry Companion for Middle School Teachers - Sample. (s.f.). Oplossingen en concentratie. [Pdf]. Hersteld van: ice.chem.wisc.edu
- Waterige oplossingen - Molariteit. Hersteld van: chem.ucla.edu
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.


Niemand heeft nog op dit artikel gereageerd.