
Calciumsulfaat (CaSO4) Chemische structuur, eigenschappen, gebruik

De calciumsulfaat Het is een ternair zout van calcium, aardalkalimetaal (Mr. Becambara), zwavel en zuurstof. De chemische formule is CaSO4, wat betekent dat voor elk kation Catwee+ er is een anion SO4twee- interactie ermee. Het vormt een verbinding met een brede verspreiding in de natuur.
De meest voorkomende vormen zijn CaSO42HtweeO (gips) en de watervrije vorm CaSO4 (het anhydriet). Er is ook een derde vorm: gips, geproduceerd door het gips te verhitten (het hemidraat, CaSO41 / 2HtweeOF). Een vast deel van dit ternaire zout wordt getoond in de onderste afbeelding, met zijn witachtige uiterlijk..

Artikel index
- 1 Chemische structuur
- 2 Eigenschappen
- 2.1 Moleculaire formule
- 2.2 Watervrij molecuulgewicht
- 2.3 Geur
- 2.4 Uiterlijk
- 2.5 Dichtheid
- 2.6 Smeltpunt
- 2.7 Oplosbaarheid
- 2.8 Stabiliteit
- 3 toepassingen
- 3.1 In constructie en art
- 3.2 Therapeutica
- 3.3 Bij voedselverwerking
- 3.4 Als meststof en conditioner voor gewasbodems
- 3.5 Bij de productie van andere verbindingen
- 4 referenties
Chemische structuur
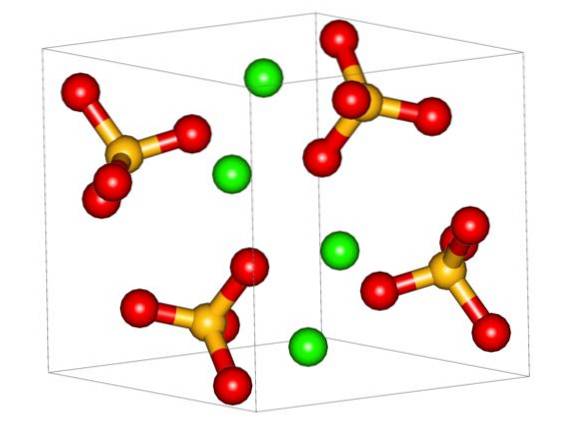
De bovenste afbeelding toont de orthorhombische eenheidscel voor CaSO4. Hier wordt aangenomen dat de interacties puur elektrostatisch zijn; dat wil zeggen, de kationen Catwee+ trekken tetraëdrische anionen aan SO4twee-.
De Catwee+ het is zeer vatbaar voor coördinatie en vormt er veelvlakkige structuren omheen. Voor wat is dit? Aan de elektronische beschikbaarheid van calcium om elektronen van basische of negatieve soorten (zoals de O-atomen van SO4twee-.
Gezien het vorige punt, nu de Ca -ionentwee+ Ze accepteren datieve koppelingen (geleverd door de Os) en de eenheidscel wordt getransformeerd, zoals aangegeven in de onderstaande afbeelding:
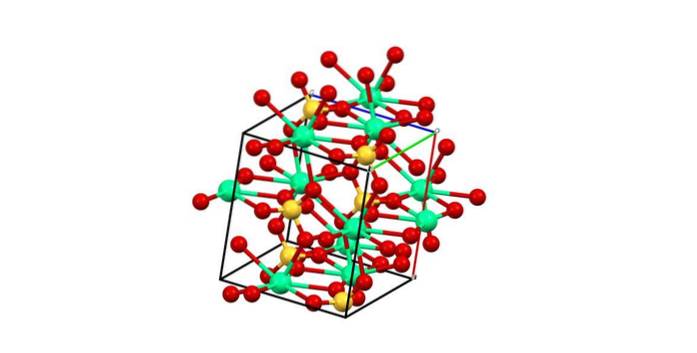
Bijgevolg wordt het veelvlak CaO gevormd8 (de groene bol van Catwee+ omringd door acht rode bollen van O van de SO tetraëders4 in de buurt). Calcium veelvlakken en sulfaattetraëders; dit is de kristallijne structuur van CaSO4 watervrij.
Bovendien, wanneer de kristallen hydrateren, waardoor het di-gehydrateerde zout of het hemidraat (CaSO41/2 uurtweeO) - de structuur breidt zich uit om watermoleculen op te nemen.
Deze moleculen kunnen intercaleren en coördineren met calcium; dat wil zeggen, ze vervangen een of twee sulfaatgroepen.
Aan de andere kant wordt niet al het water onderdeel van het CaO-veelvlak.8. Sommige vormen daarentegen waterstofbruggen met sulfaten. Deze dienen als een unie voor twee zigzagsecties, producten van de rangschikking van de ionen in het kristal.
Eigendommen
Moleculaire formule
CaSO4 nH2O.
Watervrij molecuulgewicht
136,134 g / mol.
Geur
Het is reukloos.
Uiterlijk
In het geval van anhydriet ziet het eruit als een wit poeder of vaste orthorhombische of monokliene kristallen. De kristallen hebben een variabele kleur: ze kunnen wit zijn of een blauwachtige, grijsachtige of roodachtige tint hebben; kan ook steenrood zijn.
Dichtheid
2,96 g / cm3 (watervrije vorm). 2,32 gr / cm3 (dihydraatvorm).
Smeltpunt
1450 ° C (2840 ° F). Kenmerkend voor sterke elektrostatische interacties tussen tweewaardige Ca-ionentwee+ En dus4twee-.
Oplosbaarheid
0,2-0,3% in water bij 25 ° C. Het is slecht oplosbaar in water en onoplosbaar in ethanol.
Stabiliteit
Stabiel bij kamertemperatuur.
Toepassingen

In de bouw en in de kunst
Het wordt gebruikt bij de uitwerking van stucwerk om de muren van huizen en andere constructies te bevriezen die bijdragen aan de verfraaiing ervan. Daarnaast worden reliëfs gemaakt door middel van mallen in de plafonds en raamkozijnen. Het gips zit ook in de plafonds.
Calciumsulfaat wordt gebruikt om het probleem op te lossen dat optreedt bij de hydratatie van beton, waardoor wordt samengewerkt bij de aanleg van wegen, lanen, enz..
Met de gipsen sculpturen worden vooral religieuze figuren gemaakt en op begraafplaatsen worden ze op grafstenen gebruikt.
Therapeutica
dierenarts
Experimenteel zijn in de diergeneeskunde steriele stukjes calciumsulfaat gebruikt om botdefecten of holtes te herstellen, zoals die zijn achtergelaten door wonden of tumoren..
Gips van Paris kan worden gebruikt om botdefecten te herstellen vanwege zijn unieke vermogen om osteogenese te stimuleren. Röntgenonderzoeken en technetium (Tc99m) medronaat ondersteunen het gebruik van gips uit Parijs als een alloplastische stof en de osteogene capaciteit ervan bij implantatie in de frontale sinus.
Botregeneratie is aangetoond bij zes honden in een periode van 4 tot 6 maanden. Calciumsulfaat begon in 1957 op dit gebied te worden gebruikt, in de vorm van gips van Paris-tabletten, om defecten in de botten van honden op te vullen..
De botvervanging van calciumsulfaat is vergelijkbaar met die waargenomen bij autogeen bot.
Ruhaimi (2001) bracht calciumsulfaat aan op een recentelijk vernietigd kaakbot van konijnen en observeerde een toename van osteogenese en botverkalking..
Geneesmiddel
Calciumsulfaat wordt in de geneeskunde gebruikt om ontwrichte gewrichten en gebroken botten te immobiliseren, en wordt ook gebruikt als hulpstof bij de vervaardiging van tabletten..
tandheelkunde
In de tandheelkunde wordt het gebruikt als basis voor het maken van gebitsprothesen, bij restauraties en afdrukken van tanden..
In voedselverwerking
Het wordt gebruikt als stollingsmiddel bij de productie van tofu, een voedingsmiddel gemaakt met soja en op grote schaal geconsumeerd in oosterse landen als vleesvervanger. Bovendien is het gebruikt als versteviging van voedsel en bij de behandeling van meel.
Als meststof en conditioner voor gewasbodems
Gips (CaSO42HtweeO) werd sinds de achttiende eeuw in Europa als meststof gebruikt en had het voordeel ten opzichte van het gebruik van kalk als calciumbron voor een grotere mobiliteit.
Calcium moet beschikbaar zijn voor de wortels van de planten voor voldoende toevoer. Dus de toevoeging van calcium verbetert de tuinbouw- en aardnoten (pinda) gewassen..
Pinda-wortelrot veroorzaakt door biologische ziekteverwekkers, evenals watermeloen- en tomatenbloesemrot, wordt gedeeltelijk bestreden met landbouwgipstoepassingen..
Gips helpt de verspreiding van klei te verminderen, waardoor korsten op de grond ontstaan. Door de korsten die op de grond worden gevormd te verminderen, vergemakkelijkt het gips de uitgang van de zaailingen. Het verhoogt ook het binnendringen van lucht en water naar de grond.
Gips helpt de bodem te verbeteren door de zuurgraad en toxiciteit van aluminium te verminderen, waardoor het gewas wordt aangepast aan natriumbodems.
Bij de productie van andere verbindingen
Calciumsulfaat reageert met ammoniumbicarbonaat om ammoniumsulfaat te vormen. Het is ook gebruikt in het productieproces van zwavelzuur.
Watervrij calciumsulfaat wordt gemengd met schalie of mager en, terwijl het mengsel wordt verwarmd, komt zwaveltrioxide in gasvorm vrij. Zwaveloxide is een voorloper van zwavelzuur.
Referenties
- Rookvoet. (26 december 2015). Structuur van CaSO4. [Figuur]. Opgehaald op 6 mei 2018, van: commons.wikimedia.org
- Takanori Fukami et al. (2015). Synthese, kristalstructuur en thermische eigenschappen van CaSO42HtweeOf enkele kristallen. International Journal of Chemistry; Deel 7, nr. 2; ISSN 1916-9698 E-ISSN 1916-9701 Uitgegeven door Canadian Centre of Science and Education.
- PubChem. (2018). Calciumsulfaat. Opgehaald op 6 mei 2018, van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Calciumsulfaat. Opgehaald op 6 mei 2018, van: en.wikipedia.org
- Elsevier. (2018). calciumsulfaat. Opgehaald op 6 mei 2018, van: sciencedirect.com
- Kimberlitesoftwares. (2018). Calciumsulfaat. Opgehaald op 6 mei 2018, van: worldofchemicals.com
- Intagri. (2017). Handleiding voor het gebruik van landbouwgips als bodemverbeteraar. Opgehaald op 6 mei 2018, van: intagri.com

Niemand heeft nog op dit artikel gereageerd.