
Calciumsulfide (CaS) structuur, eigenschappen, productie, gebruik

De calciumsulfide Het is een anorganische vaste stof gevormd door het element calcium (Ca) en het element zwavel (S), de chemische formule is CaS. Het is een geelachtig witte vaste stof die oplosbaar is in water en in de natuur wordt aangetroffen in sommige vulkanen en in sommige meteorieten in de vorm van een mineraal dat oldhamiet wordt genoemd..
Wanneer CaS in water oplost, vormt het verschillende verbindingen vanwege het sulfide-ion S.twee- wordt ion SH- en OH-ionen worden gevormd-. De resulterende oplossing is alkalisch. Deze verbinding wordt gebruikt als basis voor verbindingen die luminescerend zijn of die onder bepaalde omstandigheden zichtbaar licht produceren. Deze materialen worden ook gebruikt in lichtgevende verven.

CaS wordt beschouwd als een mogelijk medicijn voor de behandeling van hart- en bloedvatproblemen zoals hypertensie of hoge bloeddruk, een ziekte die een groot deel van de wereldbevolking treft.
Met calciumsulfide kunnen andere verbindingen zoals calciumnitraat en calciumcarbonaat worden verkregen. Het moet met de nodige voorzichtigheid worden gehanteerd en in contact met de vochtigheid van de atmosfeer kan het H producerentweeS wat erg giftig is.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Fysieke eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Dichtheid
- 3.5 Oplosbaarheid
- 4 Chemische eigenschappen
- 4.1 Waterige oplossing
- 4.2 Verbindingen die aanwezig zijn wanneer ze zijn opgelost in water
- 4.3 Reactie met zuren
- 4.4 Overige reacties
- 5 Verkrijgen
- 5.1 Aanwezigheid in de natuur
- 6 toepassingen
- 6.1 In lichtgevende materialen
- 6.2 In de geneeskunde
- 6.3 Bij het verkrijgen van andere verbindingen
- 6.4 Andere toepassingen
- 7 Risico's
- 8 referenties
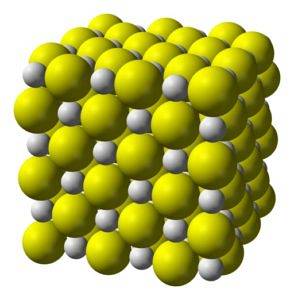
Structuur
Calciumsulfide is een sterk ionische verbinding gevormd door een calciumion Catwee+ en een sulfide-ion Stwee-.
Kristalliseert tot een kubusvormige structuur zoals steenzout.
Nomenclatuur
- Calciumsulfide
Fysieke eigenschappen
Fysieke toestand
Geelachtig witte kristallijne vaste, kubische kristallen zoals die van natriumchloride.
Molecuulgewicht
72,144 g / mol
Smeltpunt
2528 ºC
Dichtheid
2,59 g / cm3
Oplosbaarheid
Oplosbaar in water. Onoplosbaar in ethanol.
Chemische eigenschappen
Waterige oplossing
Als CaS oplost in water, scheidt het zich af in zijn calcium-Ca-ionen. twee+ en zwavel Stwee-. De laatste in water neemt een proton en wordt het hydrosulfide-ion SH- het vrijgeven van een hydroxylion OH-.
Stwee- + H.tweeO ⇔ SH- + Oh-
Daarom zijn calciumsulfide CaS-oplossingen alkalisch (hebben een basische pH) en hebben ze geen S-ionen.twee- maar SH-.
Alleen wanneer een grote hoeveelheid alkali zoals natriumhydroxide NaOH aan de oplossing wordt toegevoegd, verschuift het evenwicht naar de vorming van sulfide-ionen Stwee-.

De SH- kan nog een proton H nemen+ uit water, waarbij waterstofsulfide wordt gevormd, wat een zeer giftige verbinding is.
SH- + H.tweeO ⇔ HtweeS + OH-
Om deze reden worden in water kleine hoeveelheden H gevormd.tweeJa, en bij blootstelling aan vochtigheid in de omgeving geeft CaS een onaangename geur af die typisch is voor waterstofsulfide.
Verbindingen die aanwezig zijn wanneer ze worden opgelost in water
Het resultaat van de hierboven aangegeven reacties in water is dat Ca (SH) wordt gevormdtwee, Ca (OH)twee en Ca (SH) (OH).
CaS + HtweeO → Ca (SH) (OH)
Ca (SH) (OH) + HtweeO → Ca (OH)twee + H.tweeS
Reactie met zuren
Dezelfde reacties die in water optreden, zorgen ervoor dat CaS reageert met zuren die H vormentweeS.
CaS + 2 HCl → CaCltwee + H.tweeS
Andere reacties
Als een oplossing van calciumsulfide wordt verwarmd met zwavel, worden de polysulfide-ionen S verkregen.4twee- en S3twee-.
Als CaS wordt verwarmd in droge lucht of zuivere zuurstof, oxideert de verbinding tot calciumsulfiet CaSO3 en vervolgens naar calciumsulfaat CaSO4
2 CaS + 3 Otwee → 2 CaSO3
2 CaSO3 + OFtwee → 2 CaSO4
Met oxidatiemiddelen zoals kaliumchloraat KClO3, kaliumnitraat KNO3 of looddioxide PbOtwee gewelddadige reacties komen voor.
Het verkrijgen van
Calciumsulfide kan worden bereid door calcineren (verhitting tot zeer hoge temperatuur) van de elementen calcium (Ca) en zwavel (S) in een inerte atmosfeer, dat wil zeggen dat er bijvoorbeeld geen zuurstof of waterdamp aanwezig is..
Ca + S + warmte → CaS
Het kan ook worden verkregen door calciumsulfaat CaSO te verhitten4 met houtskool:
Geval4 + 2 C → CaS + 2 COtwee
In het laatste geval wordt echter geen zuiver CaS verkregen, aangezien het aanvullend reageert met CaSO4 vorming van CaO en SOtwee.
CaS wordt ook gegenereerd door het verbranden van kolenafval.
Aanwezigheid in de natuur
CaS is van nature aanwezig in het mineraal oldhamiet. Dit is een onderdeel van sommige meteorieten en is belangrijk voor wetenschappelijk onderzoek aan het zonnestelsel..
Oldhamite wordt verondersteld te zijn gevormd door condensatie in de nevel die het zonnestelsel heeft veroorzaakt. Het is ook aanwezig in vulkanen.

Bovendien wordt calciumsulfide van nature geproduceerd door de reductie van CaSO4 (gips) mogelijk door de werking van bacteriën.
Toepassingen
In lichtgevende materialen
Een van de meest wijdverbreide toepassingen van calciumsulfide is als basis voor lichtgevende verbindingen. Dit zijn stoffen die onder bepaalde omstandigheden zichtbaar licht uitstralen..
In de lichtgevende verbindingen van CaS fungeert dit als basis en worden activatoren aan de structuur toegevoegd zoals chloriden van bepaalde elementen zoals cerium (Ce3+) en europium (Eutwee+.
Het materiaal dat het resultaat is van de vereniging van het CaS en de activator wordt bijvoorbeeld gebruikt in kathodestraalbuisschermen die de oude schermen van computers of computers of oude tv-toestellen vormen..

Ze worden ook gebruikt in de huidige light-emitting diode of LED-lampen. Lichtgevende dioden.

Deze materialen worden ook gebruikt in lichtgevende verven en vernissen..
In de geneeskunde
Calciumsulfide is in medisch-wetenschappelijke studies beschouwd als een medicijn voor de behandeling van hoge bloeddruk (hoge druk in de slagaders). Dit is een ziekte die het cardiovasculaire systeem van veel mensen aantast (hart en bloedvaten).
CaS wordt beschouwd als een "donor" van HtweeS. Dit speelt een belangrijke rol bij het reguleren van de tonus of sterkte van bloedvaten, dus de toediening van CaS zou een mogelijke remedie kunnen zijn om hypertensie te behandelen.

Bij het verkrijgen van andere verbindingen
Calciumsulfide maakt het mogelijk om andere verbindingen te bereiden, zoals calciumnitraat Ca (NO3twee
CaS + 2 HNO3 → Ca (GEEN3twee + H.tweeS
Het is ook gebruikt om calciumcarbonaat CaCO te verkrijgen3. Om dit te doen, wordt een waterige oplossing van CaS onderworpen aan carbonatatie met COtwee
CaS + HtweeO + COtwee → H.tweeS + CaCO3
Andere apps
Calciumsulfide wordt ook gebruikt als smeermiddeladditief en als flotatiemiddel bij minerale extractie..
Risico's
Calciumsulfide kan irritatie van de huid, ogen en luchtwegen veroorzaken. Het moet met de nodige voorzichtigheid en met de juiste veiligheidsuitrusting worden gehanteerd.
Het is een zeer giftige stof voor in het water levende organismen, dus het is gevaarlijk voor deze omgevingen.
Referenties
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Lide, D.R. (editor). (2005). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Ropp, R.C. (2013). Groep 16 (O, S, Se, Te) alkalische aardeverbindingen. Calciumsulfide. In Encyclopedia of the Alkaline Earth Compounds. Opgehaald van sciencedirect.com.
- Li, Y.F. et al. (2009). Calciumsulfide (CaS), een donor van waterstofsulfide (H (2) S): een nieuw antihypertensivum? Med Hypotheses, 2009 sept .; 73 (3): 445-7. Opgehaald van ncbi.nlm.nih.gov.
- Huis J.E. en House, K.A. (2016). Zwavel, selenium en tellurium. Voorkomen van zwavel. In Descriptive Anorganic Chemistry (derde editie). Opgehaald van sciencedirect.com.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Calciumsulfide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- De Beer, M. et al. (2014). Omzetting van calciumsulfide in calciumcarbonaat tijdens het proces van terugwinning van elementaire zwavel uit gipsafval. Afvalbeheer, november 2014; 34 (11): 2373-81. Opgehaald van ncbi.nlm.nih.gov.



Niemand heeft nog op dit artikel gereageerd.