
Natriumsulfideformules, gebruik, risico's
De natriumsulfide (Na2S) is een geel tot steenrode kristallijne vaste stof. In de natuur wordt het aangetroffen in verschillende mate van hydratatie, de meest voorkomende is natriumsulfide nonahydraat (Na2S 9H2O).
Het zijn in water oplosbare zouten die sterk alkalische oplossingen geven. Wanneer ze worden blootgesteld aan vochtige lucht, absorberen ze vocht uit de lucht, kunnen ze spontaan opwarmen en ontbranden van brandbare materialen in de buurt. Evenzo stoten ze in contact met vochtige lucht waterstofsulfide uit, dat naar rotte eieren ruikt..

Het zijn sterke reductiemiddelen. Deze stoffen kunnen gevaarlijk zijn voor het milieu, vooral voor waterorganismen.
Natriummonosulfide wordt commercieel geleverd in vlokvorm die 60-62% Na bevattweeS ...
- Formules

- CAS: 1313-82-2 Natriumsulfide (watervrij)
- CAS: 1313-84-4 Natriumsulfide (nonahydraat)
2D-structuur
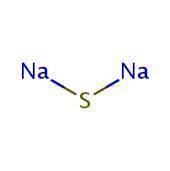
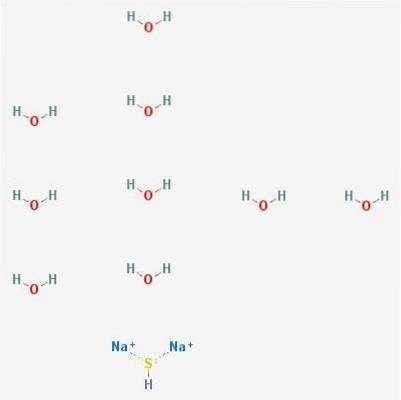
3D-structuur

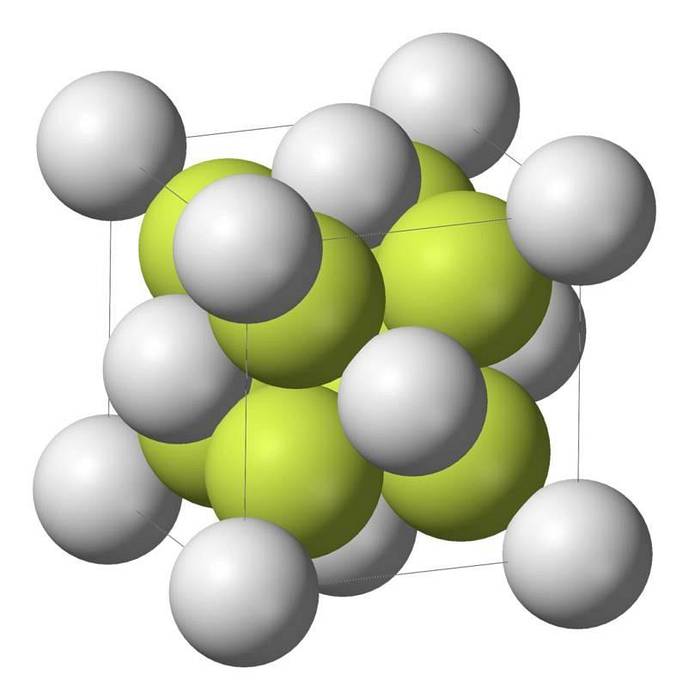
Kenmerken van natriumsulfide
Fysische en chemische eigenschappen

Natriummonosulfide (Na2S) kristalliseert met de antifluorietstructuur, waarbij elk S-atoom wordt omgeven door een kubus van 8 Na-atomen en elk Na-atoom door een tetraëder met 4 S-atomen..
Ontvlambaarheid
Het enige licht ontvlambare lid van de anorganische sulfidegroep is waterstofsulfide. Sommige andere anorganische sulfiden, zoals natriumsulfide, kunnen echter spontaan opwarmen en zelfs ontbranden bij blootstelling aan vocht..
Bij blootstelling aan vuur geeft natriumsulfide zwaveldioxidegassen of -dampen af, die irriterend of giftig zijn.
Reactiviteit
- Anorganische sulfiden zijn over het algemeen basisch (sommige zijn sterk basisch en daarom onverenigbaar met zuren).
- Veel van deze verbindingen zijn reductiemiddelen (ze reageren heftig met oxidatiemiddelen).
- Eenvoudige sulfidezouten (zoals natrium-, kalium- en ammoniumsulfide) reageren krachtig met zuren om zeer giftig en brandbaar waterstofsulfidegas vrij te maken..
- Natriumsulfide is ontvlambaar. Kan ontploffen bij snelle verhitting of geraakt worden.
- Bij verhitting tot ontbinding, geeft het giftige dampen van natriumoxide en zwaveloxiden af.
- Reageert heftig met koolstof, houtskool, diazoniumzouten, N, N-dichloormethylamine, sterk oxiderende stoffen en water.
Toxiciteit
Veel van de leden van de anorganische sulfidegroep gedragen zich als sterke basen en kunnen bij contact met de huid ernstige brandwonden veroorzaken..
Deze eigenschap hangt af van zijn oplosbaarheid. De meer onoplosbare anorganische sulfiden (bijvoorbeeld kwik (II) sulfide en cadmiumsulfide) zijn niet bijtend.
Natriumsulfide heeft een gemiddelde octanol / waterverdelingscoëfficiënt (Pow) (van -3,5). Deze waarde wordt gebruikt als maat voor de oplosbaarheid (en bioconcentratie) van een stof in dierlijk vetweefsel (vooral waterdieren)..
Natriumsulfide wordt als gevaarlijk voor het milieu beschouwd, vooral voor in het water levende organismen.
Toepassingen
Thuis wordt natriumsulfide gebruikt in afvoerreinigers, huishoudelijke schoonmaakmiddelen (voor de oven, badkamer), stijltangen, afwasmiddelzeep en auto-airbags..
In de industrie wordt het gebruikt in reinigingsmiddelen, in cement en als voorloper bij de productie van andere chemicaliën.
Klinische effecten
Blootstelling aan natriumsulfide komt veel voor in ontwikkelde en onderontwikkelde landen, zowel in de industrie als thuis. Deze bijtende stoffen zijn in lage concentraties in diverse huishoudelijke producten aanwezig..
In ontwikkelde landen zijn ernstige effecten zeldzaam. Deze komen voornamelijk voor bij opzettelijke inname van de chemische stof bij volwassenen. In ontwikkelingslanden komen ernstige effecten echter vaker voor.
Alkalische bijtende stoffen veroorzaken necrose van de liquefactie. Ze verzepen de vetten in het celmembraan, vernietigen de cel en laten een diepe penetratie toe in het slijmvliesweefsel.
Orale blootstelling
De eerste ontsteking treedt op in het maagdarmweefsel, gevolgd door weefselnecrose (met mogelijke perforatie), vervolgens granulatie en tenslotte de vorming van strictuur.
Patiënten met milde inname ontwikkelen graad I irritatie of brandwonden (oppervlakkige hyperemie en oedeem) van de orofarynx, slokdarm of maag..
Patiënten met matige intoxicatie kunnen brandwonden van graad II ontwikkelen (oppervlakkige blaren, erosies en ulceraties) met mogelijke daaropvolgende vernauwing (met name slokdarm)..
Sommige patiënten (vooral jonge kinderen) kunnen oedeem van de bovenste luchtwegen krijgen.
Patiënten met ernstige intoxicatie door inslikken kunnen diepe brandwonden en necrose van het gastro-intestinale slijmvlies krijgen, met complicaties zoals: perforatie (slokdarm, maag, zelden duodenaal), fistelvorming (tracheo-oesofageaal, aortoesofageaal) en gastro-intestinale bloeding..
Kan zich ontwikkelen: hypotensie, tachycardie, tachypneu, vernauwing (voornamelijk slokdarm), slokdarmcarcinoom en oedeem van de bovenste luchtwegen (wat vaak voorkomt en vaak levensbedreigend is).
Ernstige intoxicatie is over het algemeen beperkt tot opzettelijke inname bij volwassenen.
Blootstelling door inademing
Milde blootstelling kan hoesten en bronchospasmen veroorzaken.
Ernstige inademing kan oedeem van de bovenste luchtwegen, brandwonden, stridor en in zeldzame gevallen acuut longletsel veroorzaken..
Oculaire blootstelling
Het kan ernstige conjunctivale irritatie en chemose, cornea-epitheliale defecten, limbische ischemie, permanent gezichtsverlies en in ernstige gevallen van perforatie veroorzaken.
Huidblootstelling
Milde blootstelling veroorzaakt irritatie en brandwonden van gedeeltelijke dikte. Metabole acidose kan optreden bij patiënten met ernstige brandwonden of shock..
Langdurige blootstelling of producten met een hoge concentratie kunnen brandwonden over de gehele dikte veroorzaken.
Veiligheid en risico's
Gevarenaanduidingen van het wereldwijd geharmoniseerde systeem voor de classificatie en etikettering van chemicaliën (GHS)
Het Globally Harmonized System of Classification and Labelling of Chemicals (GHS) is een internationaal overeengekomen systeem, gecreëerd door de Verenigde Naties en ontworpen om de verschillende classificatie- en etiketteringsnormen die in verschillende landen worden gebruikt te vervangen door wereldwijd consistente criteria te gebruiken..
De gevarenklassen (en hun overeenkomstige GHS-hoofdstuk), classificatie- en etiketteringsnormen en aanbevelingen voor natriumsulfide zijn als volgt (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):







Referenties
- Benjah-bmm27, (2006). Fluoriet-eenheid-cel-3D-ionisch [afbeelding] Hersteld van: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [afbeelding] Hersteld van: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-structuur van 1313-82-2 - Natriumsulfide [afbeelding] Hersteld van: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-structuur van 1313-84-4 - Natriumsulfide [afbeelding] Hersteld van: chem.nlm.nih.gov.
- Europees Agentschap voor chemische stoffen (ECHA). (2017). Samenvatting van classificatie en etikettering.
- Geharmoniseerde classificatie - Bijlage VI van Verordening (EG) nr.1272 / 2008 (CLP-verordening). Natriumsulfide. Opgehaald op 16 januari 2017, van: echa.europa.eu.
- Europees Agentschap voor chemische stoffen (ECHA). (2017). Samenvatting van classificatie en etikettering.
- Aangemelde classificatie en etikettering. Natriumsulfide, gehydrateerd. Opgehaald op 16 januari 2017, van: echa.europa.eu.
- Gegevensbank gevaarlijke stoffen (HSDB). TOXNET. (2017). Natriumsulfide. Bethesda, MD, EU: National Library of Medicine. Hersteld van: toxnet.nlm.nih.gov.
- Lange, L., en Triebel, W. (2000). Sulfiden, polysulfiden en sulfanen. In Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Opgehaald van dx.doi.org.
- Verenigde Naties (2015). Wereldwijd geharmoniseerd systeem voor classificatie en etikettering van chemische stoffen (GHS) zesde herziene editie. New York, EU: publicatie van de Verenigde Naties. Hersteld van: unece.org.
- Nationaal centrum voor informatie over biotechnologie. PubChem samengestelde database. (2016). Natriumsulfide-enneahydraat - PubChem-structuur [afbeelding] Teruggeplaatst van: pubchem.ncbi.nlm.nih.gov.
- Nationaal centrum voor informatie over biotechnologie. PubChem samengestelde database. (2017). Natriummonosulfide. Bethesda, MD, EU: National Library of Medicine. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Nationaal centrum voor informatie over biotechnologie. PubChem samengestelde database. (2017). Natriumsulfide-enneahydraat. Bethesda, MD, EU: National Library of Medicine. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Nationale Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Chemisch gegevensblad. Natriumsulfide, watervrij. Silver Spring, MD. EU; Hersteld van: cameochemicals.noaa.gov.
- Nationale Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Reactive Group Datasheet. Sulfiden, anorganisch. Silver Spring, MD. EU; Hersteld van: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [afbeelding] Hersteld van: wikipedia.org.
- PubChem, (2016). Natriummonosulfide [afbeelding] Hersteld van: puchem.nlm.nih.gov.
- PubChem, (2016). Natriumsulfide-enneahydraat [afbeelding] Hersteld van: puchem.nlm.nih.gov.
- Wikipedia. (2017). Verdelingscoëfficiënt octanol-water. Opgehaald op 17 januari 2017, van: wikipedia.org.
- .


Niemand heeft nog op dit artikel gereageerd.