
Structuur, eigenschappen en toepassingen van zinksulfide (ZnS)
De zinksulfide is een anorganische verbinding met formule ZnS, gevormd door Zn-kationentwee+ en S anionentwee-. Het komt in de natuur voornamelijk voor als twee mineralen: wurtziet en sfaleriet (of zinkblende), de laatste is de belangrijkste vorm.
Sfaleriet is zwart van aard vanwege de onzuiverheden die het presenteert. In zijn pure vorm heeft het witte kristallen, terwijl wurtziet grijsachtig witte kristallen heeft..

Zinksulfide is onoplosbaar in water. Het kan milieuschade veroorzaken, omdat het de bodem binnendringt en het grondwater en zijn stromingen vervuilt.
Zinksulfide kan onder meer worden geproduceerd door corrosie en door neutralisatie.
Door corrosie:
Zn + HtweeS => ZnS + Htwee
Door neutralisatie:
H.tweeS + Zn (OH)twee => ZnS + 2HtweeOF
Zinksulfide is een fosforescerend zout, waardoor het geschikt is voor meerdere toepassingen en toepassingen. Bovendien is het een halfgeleider en een fotokatalysator.
Artikel index
- 1 Structuur
- 1.1 Zinkblende
- 1.2 Wurzita
- 2 Eigenschappen
- 2.1 Kleur
- 2.2 Smeltpunt
- 2.3 Oplosbaarheid in water
- 2.4 Oplosbaarheid
- 2.5 Dichtheid
- 2.6 Hardheid
- 2.7 Stabiliteit
- 2.8 Ontleding
- 3 Nomenclatuur
- 3.1 Systematische en traditionele nomenclaturen
- 4 toepassingen
- 4.1 Als pigmenten of coatings
- 4.2 Vanwege zijn fosforescentie
- 4.3 Halfgeleider, fotokatalysator en katalysator
- 5 referenties
Structuur
Zinksulfide neemt kristallijne structuren aan die worden beheerst door elektrostatische aantrekkingen tussen het Zn-kationtwee+ en het anion Stwee-. Dit zijn er twee: sfaleriet of zinkblende en wurziet. In beide minimaliseren de ionen de afstoting tussen ionen met gelijke ladingen..
De zinkblende is het meest stabiel onder de aardse omstandigheden van druk en temperatuur; en wurziet, dat minder dicht is, is het resultaat van kristallijne herschikking als gevolg van verhoogde temperatuur.
De twee structuren kunnen tegelijkertijd naast elkaar bestaan in dezelfde ZnS-vaste stof, hoewel, heel langzaam, de wurziet zal domineren..
Zinkblende

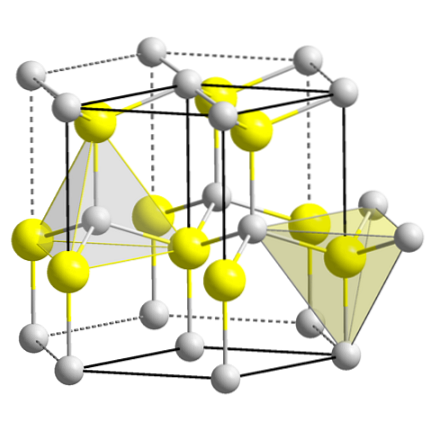
De bovenste afbeelding toont de kubieke eenheidscel gecentreerd op de vlakken van de zinkblende-structuur. De gele bollen komen overeen met de anionen Stwee-, en de grijze tot de Zn-kationentwee+, gelegen op de hoeken en in het midden van de kubusvlakken.
Let op de tetraëdrische geometrieën rond de ionen. De zinkblende kan ook worden weergegeven door deze tetraëders, waarvan de gaten in het kristal dezelfde geometrie hebben (tetraëdrische gaten).
Evenzo wordt binnen de eenheidscellen aan het ZnS-aandeel voldaan; dat wil zeggen een verhouding van 1: 1. Dus voor elk Zn-kationtwee+ er is een anion Stwee-. In de afbeelding lijkt het misschien dat er veel grijze bollen zijn, maar in werkelijkheid, omdat ze zich in de hoeken en het midden van de vlakken van de kubus bevinden, worden ze gedeeld door andere cellen.
Als je bijvoorbeeld de vier gele bollen neemt die in de doos zitten, moeten de "stukjes" van alle grijze bollen eromheen gelijk zijn (en dat is ook zo). Dus in de kubieke eenheidscel zijn er vier Zntwee+ en vier Stwee-, voldoen aan de stoichiometrische verhouding ZnS.
Het is ook belangrijk om te benadrukken dat er tetraëdrische gaten zijn voor en achter de gele bollen (de ruimte die ze van elkaar scheidt).
Wurzita
In tegenstelling tot de structuur van zinkblende, gebruikt wurziet een hexagonaal kristalsysteem (bovenste afbeelding). Dit is minder compact, waardoor de vaste stof een lagere dichtheid heeft. De ionen in wurziet hebben ook een tetraëdrische omgeving en een verhouding van 1: 1 die overeenkomt met de ZnS-formule..
Eigendommen
Kleur
Het kan op drie manieren worden gepresenteerd:
-Wurtziet, met witte en zeshoekige kristallen.
-Sfaleriet, met grijswitte kristallen en kubische kristallen.
-Als een wit tot grijsachtig wit of geelachtig poeder en kubische geelachtige kristallen.
Smeltpunt
1700 ° C.
Oplosbaarheid in water
Vrijwel onoplosbaar (0.00069 g / 100 ml bij 18º C).
Oplosbaarheid
Onoplosbaar in basen, oplosbaar in verdunde minerale zuren.
Dichtheid
Sfaleriet 4,04 g / cm3 en wurtziet 4,09 g / cm3.
Hardheid
Heeft een hardheid van 3 tot 4 op de schaal van Mohs.
Stabiliteit
Als het water bevat, oxideert het langzaam tot sulfaat. In een droge omgeving is het stabiel.
Ontleding
Bij verhitting tot hoge temperaturen geeft het giftige dampen van zink en zwaveloxiden af.
Nomenclatuur
De elektronenconfiguratie van Zn is [Ar] 3d104stwee. Door de twee elektronen van de 4s-orbitaal te verliezen, blijft het als het Zn-kationtwee+ met hun d orbitalen gevuld. Daarom, aangezien elektronisch Zntwee+ het is veel stabieler dan Zn+, het heeft slechts een valentie van +2.
Daarom is het weggelaten voor de voorraadnomenclatuur, waarbij de valentie tussen haakjes en met Romeinse cijfers wordt toegevoegd: zinksulfide (II).
Systematische en traditionele nomenclaturen
Maar er zijn andere manieren om de ZnS te bellen naast degene die al is verhoogd. In systematiek wordt het aantal atomen van elk element gespecificeerd met de Griekse tellers; met als enige uitzondering het element aan de rechterkant als het er maar één is. De ZnS wordt dus genoemd als: aapzinksulfide (en niet monozinkmonosulfide).
Met betrekking tot de traditionele nomenclatuur wordt zink met een enkele valentie van +2 toegevoegd door het achtervoegsel -ico toe te voegen. Bijgevolg resulteert de traditionele naam: zinksulfideico.
Toepassingen
Als pigmenten of coatings
-Sachtolith is een wit pigment gemaakt met zinksulfide. Gebruikt in kit, mastiek, kitten, onderlagen, latexverven en bewegwijzering.
Het gebruik ervan in combinatie met ultraviolet licht absorberende pigmenten, zoals microtitanium of transparante ijzeroxidepigmenten, is noodzakelijk in weerbestendige pigmenten.
-Wanneer ZnS wordt aangebracht op latex- of structuurverven, heeft het een langdurige microbicide werking.
-Vanwege zijn grote hardheid en weerstand tegen breuk, erosie, regen of stof, maakt het het geschikt voor infraroodramen buiten of in vliegtuigframes.
-ZnS wordt gebruikt bij het coaten van rotoren die worden gebruikt bij het transport van compounds, om slijtage te verminderen. Het wordt ook gebruikt bij de productie van drukinkten, isolatiematerialen, thermoplastische pigmentatie, vlambestendige kunststoffen en elektroluminescente lampen..
-Zinksulfide kan transparant zijn en kan worden gebruikt als venster voor zichtbare optiek en infraroodoptiek. Gebruikt in nachtkijkers, televisieschermen, radarschermen en fluorescerende coatings.
-ZnS met Cu-doping wordt gebruikt bij de productie van elektroluminescentiepanelen. Het wordt ook gebruikt bij de voortstuwing van raketten en gravimetrie.
Om zijn fosforescentie
-De fosforescentie wordt gebruikt om de wijzers te kleuren en zo de tijd in het donker weer te geven; ook in verf voor speelgoed, in noodborden en verkeerswaarschuwingen.
Door fosforescentie kan het gebruik van zinksulfide in kathodestraalbuizen en röntgenschermen op donkere plekken oplichten. De kleur van de fosforescentie is afhankelijk van de gebruikte activator.
Halfgeleider, fotokatalysator en katalysator
-Sfaleriet en wurtziet zijn breedband gespleten halfgeleiders. Sphalerite heeft een bandspleet van 3,54 eV, terwijl wurtzite een bandspleet van 3,91 eV heeft.
-ZnS wordt gebruikt bij de bereiding van een fotokatalysator die is samengesteld uit CdS - ZnS / zirkonium - titaniumfosfaat dat wordt gebruikt voor de productie van waterstof onder zichtbaar licht.
-Het werkt als katalysator voor de afbraak van organische verontreinigende stoffen. Gebruikt bij de voorbereiding van een kleurensynchronisator in LED-lampen.
-De nanokristallen worden gebruikt voor ultragevoelige eiwitdetectie. Bijvoorbeeld door licht uit te zenden van kwantumstippen van ZnS. Het wordt gebruikt bij de bereiding van een gecombineerde fotokatalysator (CdS / ZnS) -TiO2 voor elektrische productie via foto-elektrokatalyse.
Referenties
- PubChem. (2018). Zinksulfide. Genomen uit: pubchem.ncbi.nlm.nih.gov
- QuimiNet. (2015, 16 januari). Wit pigment op basis van zinksulfide. Hersteld van: quiminet.com
- Wikipedia. (2018). Zinksulfide. Genomen uit: en.wikipedia.org
- II-VI UK. (2015). Zinksulfide (ZnS). Genomen uit: ii-vi.es
- Rob Toreki. (2015, 30 maart). De Zincblende (ZnS) -structuur. Genomen van: ilpi.com
- Chemie LibreTexts. (22 januari 2017). Structuur-zinkblende (ZnS). Genomen uit: chem.libretexts.org
- Reade. (2018). Zinksulfide / zinksulfide (ZnS). Genomen van: reade.com



Niemand heeft nog op dit artikel gereageerd.