
Aromatische nucleofiele substitutie-effecten, voorbeelden
De aromatische nucleofiele substitutie (SNAr) is een reactie die optreedt in de organische chemie, die bestaat uit de verplaatsing van een goede vertrekkende groep door een inkomend nucleofiel. Vanuit het oogpunt van zijn mechanisme en elektronische aspecten is het de tegenovergestelde kant van de elektrofiele aromatische substitutie (SEAr).
Over het algemeen is de vertrekkende groep een halogeen, dat naar buiten komt als een halogenide-anion X-. Deze reactie kan alleen plaatsvinden als de aromatische ring (meestal benzeen) een tekort aan elektronen heeft; dat wil zeggen, als het elektronenzuigende substituentgroepen heeft.

De bovenste afbeelding schetst wat er in de vorige paragraaf is gezegd. De elektronenaantrekorgroep EWG (voor het acroniem in het Engels: Groep voor het terugtrekken van elektronen), activeert de aromatische ring voor de nucleofiele aanval van de negatieve soort Nu-. Het is te zien dat een tussenproduct wordt gevormd (in het midden), waaruit het halogenide X wordt vrijgegeven of uitgaat-.
Merk op dat in eenvoudige bewoordingen X wordt vervangen door Nu in een aromatische ring. Deze reactie is zeer veelzijdig en noodzakelijk bij de synthese van nieuwe geneesmiddelen, evenals bij studies op het gebied van synthetische organische chemie..
Artikel index
- 1 Algemene aspecten
- 1.1 Verschillen met de elektrofiele aromatische substitutie
- 2 effecten
- 2.1 Van het aantal substituenten
- 2.2 Van de vertrekkende groep
- 3 Voorbeeld
- 3.1 Slotopmerking
- 4 referenties
Algemene kenmerken
De aromatische ring kan worden "geladen" of "ontladen" van elektronen, afhankelijk van wat de substituenten zijn (die de originele C-H-binding vervangen).
Wanneer deze substituenten elektronendichtheid aan de ring kunnen afstaan, zouden ze deze verrijken met elektronen; Als ze daarentegen attractoren zijn van elektronendichtheid (de hierboven genoemde EWG), dan wordt er gezegd dat ze de ring van elektronen verarmen.
In beide gevallen wordt de ring geactiveerd voor een specifieke aromatische reactie, terwijl deze voor de andere wordt gedeactiveerd..
Er wordt bijvoorbeeld gezegd dat een elektronenrijke aromatische ring actief is voor elektrofiele aromatische substitutie; dat wil zeggen, het kan zijn elektronen doneren aan een elektrofiele soort, E.+. Het zal echter geen elektronen doneren aan een Nu-soort-, omdat negatieve ladingen elkaar zouden afstoten.
Als de ring nu arm is aan elektronen, kan hij ze niet aan soort E geven+ (SEAr komt niet voor); aan de andere kant heeft het de mogelijkheid om de elektronen van de Nu-soort te accepteren- (de SNAr is ontwikkeld).
Verschillen met aromatische elektrofiele substitutie
Nadat de algemene inputaspecten zijn verduidelijkt, kunnen nu enkele verschillen tussen de SNAr en de SEAr worden opgesomd:
- De aromatische ring werkt als een elektrofiel (elektron-deficiëntie) en wordt aangevallen door een nucleofiel.
- Een vertrekkende groep X wordt gesubstitueerd op de ring; niet een H+
- Carbocaties worden niet gevormd, maar tussenpersonen met een negatieve lading die door resonantie kunnen worden gedelokaliseerd
- De aanwezigheid van meer attractorgroepen in de ring versnelt de substitutie in plaats van deze te vertragen
- Ten slotte hebben deze groepen geen sturende effecten op waar (op welke koolstof) de substitutie zal plaatsvinden. De substitutie vindt altijd plaats op het koolstofatoom dat aan de vertrekkende groep X vastzit.
Het laatste punt wordt ook geïllustreerd in de afbeelding: de C-X-binding breekt om de nieuwe C-Nu-binding te vormen.
Effecten bewerken
Van het aantal substituenten
Hoe meer elektronenarm de ring is, des te sneller het rSNA en des te minder ingrijpende de voorwaarden zijn natuurlijk. Beschouw het volgende voorbeeld dat in de onderstaande afbeelding wordt weergegeven:
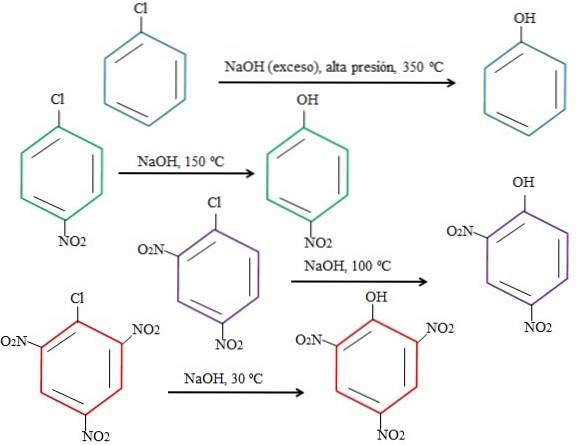
Merk op dat 4-nitrochloorbenzeen (blauwe ring) drastische voorwaarden vereist (hoge druk en een temperatuur van 350 ºC) om de substitutie van Cl door OH te laten plaatsvinden. In dit geval is chloor de vertrekkende groep (Cl-), en hydroxide het nucleofiel (OH-.
Als de groep NO verschijnttwee, wat een elektronenaantrekker is (groene ring), kan de substitutie worden uitgevoerd bij een temperatuur van 150 ° C bij omgevingsdruk. Naarmate het aantal NO-groepen toeneemttwee aanwezig (paarse en rode ringen), vindt de vervanging plaats bij lagere en lagere temperaturen (respectievelijk 100 ° C en 30 ° C).
Daarom zijn de groepen dat NIETtwee versnellen rSNA en beroven de ring van elektronen, waardoor het gevoeliger wordt voor OH-aanval-.
De relatieve posities van Cl ten opzichte van NO zullen hier niet worden uitgelegd.twee in 4-nitrochloorbenzeen, en hoe deze de reactiesnelheid veranderen; De reactiesnelheden van 2-nitrochloorbenzeen en 3-nitrochloorbenzeen zijn bijvoorbeeld verschillend, waarbij de laatste de langzaamste is in vergelijking met de andere isomeren.
Van de uitgaande groep
Door 4-nitrochloorbenzeen opnieuw te gebruiken, is de substitutiereactie langzamer in vergelijking met zijn gefluoreerde tegenhanger:
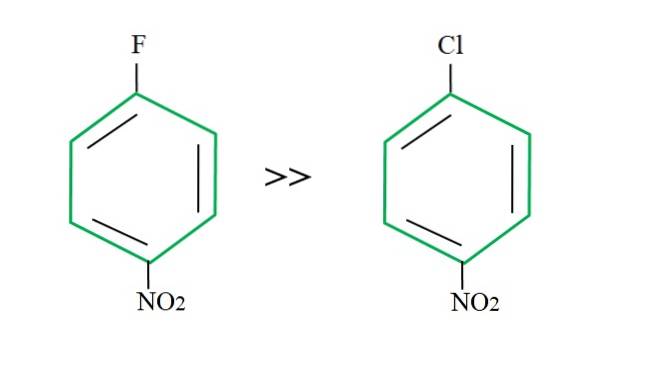
De verklaring hiervoor kan niet in een andere variabele liggen dan het verschil tussen F en Cl.Fluor is een verschrikkelijke vertrekkende groep, aangezien de C-F-binding moeilijker te verbreken is dan de C-Cl-binding. Het verbreken van deze band is dus niet de bepalende stap van de snelheid voor de SNAr, maar de toevoeging van de Nu- aan de aromatische ring.
Omdat fluor elektronegatiever is dan chloor, heeft het koolstofatoom dat eraan is gekoppeld een grotere elektronische tekortkoming (C.δ+-F.δ-Bijgevolg is de koolstof van de C-F-binding veel gevoeliger voor aanvallen door Nu- dan die van de C-Cl-binding. Dat is de reden waarom de substitutie van F door OH veel sneller is dan die van Cl door OH.
Voorbeeld
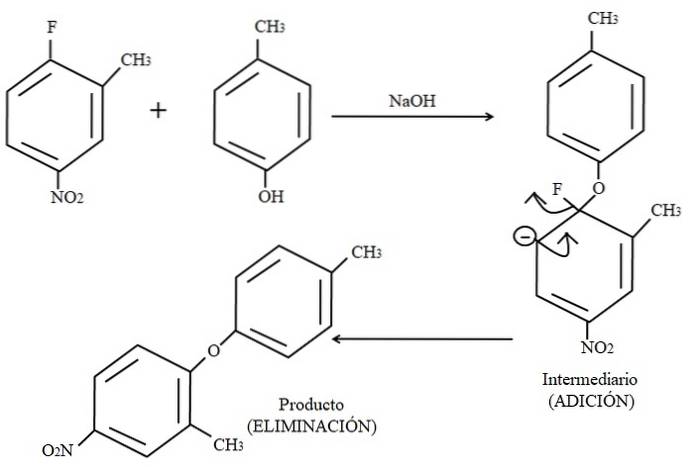
Ten slotte wordt een voorbeeld van dit soort organische reacties hieronder weergegeven in de bovenstaande afbeelding. Para-cresol lijkt geen nucleofiel te zijn; maar aangezien er een basismedium is, wordt de OH-groep gedeprotoneerd, waardoor het achterblijft als een fenoxide-anion, dat 2-methyl-4-nitrofluorbenzeen aantast.
Wanneer deze aanval plaatsvindt, wordt gezegd dat het nucleofiel bijdraagt aan het elektrofiel (de aromatische ring van 2-methyl-4-nitrofluorbenzeen). Deze stap is te zien aan de rechterkant van de afbeelding, waar de tussenverbinding wordt gevormd met beide substituenten die tot de ring behoren.
Wanneer para-cresol wordt toegevoegd, verschijnt er een negatieve lading die wordt gedelokaliseerd door resonantie binnen de ring (merk op dat het niet langer aromatisch is).
Alleen de laatste resonantiestructuur is te zien in de afbeelding, waarvan de fluor eindigt als F-maar in werkelijkheid wordt de negatieve lading gedelokaliseerd, zelfs in de zuurstofatomen van de NO-groeptwee. Na de toevoegstap komt de eliminatiestap, de laatste, en dat is wanneer het product uiteindelijk wordt gevormd.
Laatste opmerking
De groep nrtwee restant kan worden teruggebracht tot de NH-groeptwee, en van daaruit is het mogelijk om meer synthesereacties uit te voeren om het uiteindelijke molecuul te modificeren. Dit benadrukt het synthetische potentieel van rSNA en dat het mechanisme ervan ook uit twee stappen bestaat: een voor toevoeging en een voor eliminatie..
Momenteel is er echter experimenteel en computationeel bewijs dat de reactie daadwerkelijk verloopt volgens een gecoördineerd mechanisme, waarbij beide stappen gelijktijdig plaatsvinden via een geactiveerd complex en niet via een tussenproduct..
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Wikipedia. (2019). Nucleofiele aromatische substitutie. Hersteld van: en.wikipedia.org
- James Ashenhurst. (06 september 2019). Nucleofiele aromatische substitutie (NAS). Hersteld van: masterorganicchemistry.com
- Chemie LibreTexts. (05 juni 2019). Nucleofiele aromatische substitutie. Hersteld van: chem.libretexts.org



Niemand heeft nog op dit artikel gereageerd.