
Reden, technieken en toepassingen voor het kleuren van sporen

De sporenkleuring Het is de methode die wordt gebruikt om de resistentiestructuren te kleuren die bepaalde bacteriële geslachten vormen wanneer ze zich in ongunstige omstandigheden bevinden; deze structuren komen overeen met een vorm van overleven.
Er zijn veel geslachten die sporen vormen; de belangrijkste zijn echter Bacillus en Clostridium. Deze geslachten worden als relevanter beschouwd omdat ze soorten hebben die pathogeen zijn voor mensen..
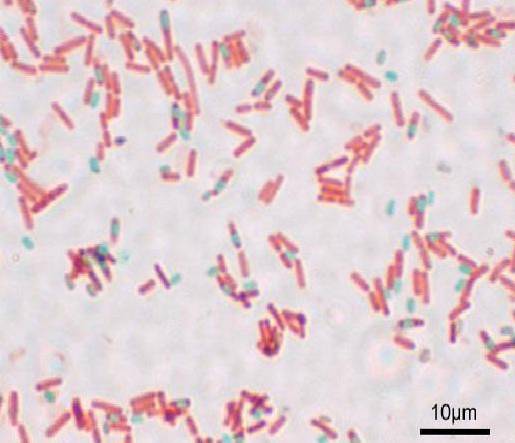
Elke bacil kan aanleiding geven tot een spoor. Op het moment dat het preparaat wordt gekleurd, bevindt de sporen zich in de bacil (endospore) of daarbuiten (exospore). Met conventionele kleuringstechnieken voor bacteriën, zoals de Gramkleuring, blijven de sporen kleurloos.
Momenteel zijn er verschillende kleuringsmethoden die in staat zijn om de dikke structuur van de sporen te penetreren om deze te verven. Deze methodieken zijn zeer gevarieerd; Deze omvatten de Dorner-techniek, de Möeller-kleuring en de Shaeffer-Fulton-methodologie, ook bekend als Wirtz-Conklin..
Van alle genoemde technieken wordt de Shaeffer-Fulton-methodologie het meest gebruikt in routinelaboratoria. Het is genoemd naar twee microbiologen die de kleuring in 1930 hebben gemaakt: Alicia Shaeffer en MacDonald Fulton. De techniek wordt echter ook wel Wirtz-Conklin genoemd ter ere van twee bacteriologen uit de jaren 1900..
Artikel index
- 1 Grondgedachte
- 2 Sporekleuringstechnieken
- 2.1 Dorner-techniek
- 2.2 Gewijzigde Dorner-techniek
- 2.3 Shaeffer-Fulton- of Wirtz-Conklin-techniek
- 2.4 Möeller-techniek
- 2.5 Gemodificeerde Möeller-techniek zonder warmte
- 3 toepassingen
- 3.1 Voorbeelden
- 4 referenties
Basis
De sporen kleuren niet met conventionele vlekken omdat ze een erg dikke wand hebben. De complexe samenstelling van de sporen verhindert het binnendringen van de meeste kleurstoffen.
Als de sporen van buiten naar binnen worden bestudeerd, worden de volgende lagen waargenomen: de eerste is het exosporium, de dunste en buitenste laag gevormd door glycoproteïnen.
Vervolgens komt de cuticula, die weerstand biedt tegen hoge temperaturen, gevolgd door de cortex die is samengesteld uit peptidoglycaan. Later is de wand van de basis die de protoplast beschermt.
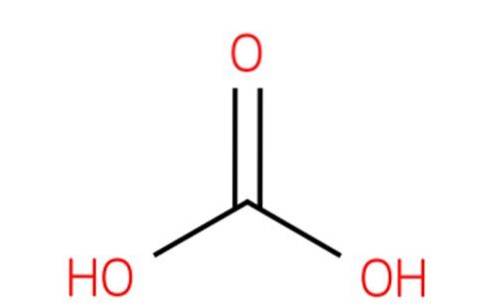
De sporen zijn een gedehydrateerde structuur die 15% calcium en dipicolinezuur bevat. Om deze reden zijn de meeste technieken voor het kleuren van sporen afhankelijk van de toepassing van warmte, zodat de kleurstof de dikke structuur kan binnendringen..
Als de sporen eenmaal zijn gekleurd, kan deze de kleurstof niet verwijderen. Bij de Shaeffer-Fulton-techniek komt malachietgroen de vegetatieve cellen binnen en, wanneer warmte wordt toegepast, dringt het ook door in de endospore en exosporen..
Door te wassen met water wordt de kleurstof uit de vegetatieve cel verwijderd. Dit komt omdat de malachietgroene kleurstof enigszins basisch is, dus het bindt zich zwak aan de vegetatieve cel..
In plaats daarvan kan het niet uit de sporen komen en wordt de bacil uiteindelijk tegengekleurd met safranine. Deze basis geldt voor de rest van de technieken, waarin iets soortgelijks gebeurt.
Spore-kleuringstechnieken
Om de sporenkleuring uit te voeren, moet je een zuivere cultuur hebben van de verdachte soort die je wilt bestuderen..
De kweek wordt 24 uur aan extreme temperaturen onderworpen om het micro-organisme te stimuleren tot sporenvorming. Hiervoor kan de cultuur gedurende 24 of 48 uur in een oven op 44 ° C of in een koelkast (8 ° C) worden geplaatst..
Indien te lang gelaten bij de genoemde temperaturen, zullen alleen exosporen worden waargenomen, aangezien alle endosporen de bacil al hebben verlaten.
Aan het einde van de tijd moeten een paar druppels steriele fysiologische oplossing op een schoon objectglaasje worden geplaatst. Vervolgens wordt een klein deel van de kweek genomen en wordt er een fijne spread gemaakt.
Het wordt vervolgens gedroogd, in de hitte gezet en geverfd met een van de onderstaande technieken:
Dorner-techniek
1- Bereid een geconcentreerde suspensie van het gesporuleerde micro-organisme in gedestilleerd water in een reageerbuis en voeg een gelijk volume gefilterde Kinyoun carbol fuchsine toe.
2- Plaats de buis 5 tot 10 minuten in een kokend waterbad.
3- Meng op een schoon objectglaasje een druppel van de vorige suspensie met een druppel van een 10% waterige oplossing van nigrosine, gekookt en gefilterd..
4- Verspreid en droog snel met zachte hitte.
5- Onderzoek met een 100X-objectief (onderdompeling).
Sporen kleuren rood en bacteriële cellen zien er bijna kleurloos uit tegen een donkergrijze achtergrond.
Gewijzigde Dorner-techniek
1- Een suspensie van het gesporuleerde micro-organisme wordt uitgespreid op een objectglaasje en gefixeerd in de hitte.
2- Het monster wordt bedekt met een strook filtreerpapier waaraan carbolic fuchsine is toegevoegd. De kleurstof wordt 5 tot 7 minuten verwarmd met de vlam van de bunsenbrander totdat er dampen ontstaan. Vervolgens wordt het papier verwijderd.
3- Het preparaat wordt gewassen met water en vervolgens gedroogd met absorberend papier.
4- Bedek het uitstrijkje met een dunne film van 10% nigrosine, gebruik een tweede glaasje om de nigrosine of een naald te verspreiden.
De kleuring die sporen en bacteriën opnemen is dezelfde als die beschreven in de stand van de techniek.
Shaeffer-Fulton- of Wirtz-Conklin-techniek
1- Maak een fijn uitstrijkje met een suspensie van het gesporuleerde micro-organisme op een glaasje en fixeer het op verhitting.
2- Bedek het objectglaasje met 5% malachietgroene waterige oplossing (een filtreerpapier kan op het objectglaasje worden geplaatst).
3- Verhit boven de vlam van de bunsenbrander om dampen te laten vrijkomen en de vlam te verwijderen. Herhaal de handeling gedurende 6 tot 10 minuten. Als de malachietgroene oplossing tijdens de procedure te veel verdampt, meer.
4- Verwijder het filterpapier (indien geïnstalleerd) en was het met water.
5- Bedek het objectglaasje gedurende 30 seconden met 0,5% waterig safranine (sommige varianten van de techniek gebruiken 0,1% waterig safranine en laten dit 3 minuten staan).
Bij deze techniek worden de sporen groen en de bacillen rood..
Het nadeel is dat de endosporen van jonge culturen niet goed kleuren, omdat ze extreem helder of kleurloos lijken. Om dit te voorkomen, wordt aanbevolen om culturen van 48 uur incubatie te gebruiken..
Möeller-techniek
1- Bedek het uitstrijkje gedurende 2 minuten met chloroform.
2- Gooi de chloroform weg.
3- Dek af met 5% chroomzuur gedurende 5 minuten.
4- Wassen met gedestilleerd water
5- Het laken is bedekt met carbol fuchsin-fenicada en blootgesteld aan de vlam van de bunsenbrander tot de uitstoot van dampen; daarna wordt het voor enkele ogenblikken uit de vlam verwijderd. De bewerking wordt herhaald totdat 10 minuten zijn voltooid.
6- Wassen met water.
7- Gebruik aangezuurde ethanol (zoutzuur alcohol) om te verkleuren. Laat 20 of 30 seconden intrekken.
8- Wassen met gedestilleerd water.
9- Contrasteer het door het laken gedurende 5 minuten met methyleenblauw te bedekken.
10- Wassen met gedestilleerd water.
11- Laat het drogen en breng het monster naar de microscoop.
De sporen zijn rood en de bacillen blauw. Het is belangrijk om de dampen niet in te ademen, aangezien deze giftig zijn en op lange termijn kankerverwekkend kunnen zijn..
Heatless gemodificeerde Möeller-techniek
In 2007 creëerden Hayama en zijn medewerkers een modificatie van de Möeller-techniek. Ze elimineerden de stap van het verwarmen van de kleurstof en vervingen deze door 2 druppels van de oppervlakteactieve stof Tergitol 7 toe te voegen voor elke 10 ml carbol-fuchsine-carbol-oplossing. Dezelfde resultaten werden verkregen.
Toepassingen
Het kleuren van sporen levert zeer waardevolle en nuttige informatie op voor de identificatie van de ziekteverwekker, aangezien zijn aanwezigheid, zijn vorm, locatie binnen de bacil en het vermogen om de vegetatieve cel al dan niet te vervormen, gegevens zijn die de betrokken soort kunnen leiden. bepaald genre.
In deze context is het de moeite waard om te zeggen dat de sporen rond of ovaal kunnen zijn, ze kunnen zich in het midden bevinden of ook in een paracentrale, subminale of terminale positie..
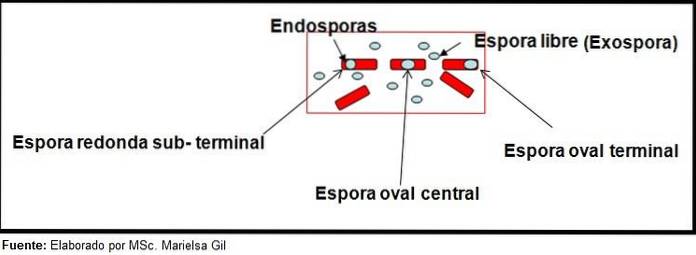
Voorbeelden
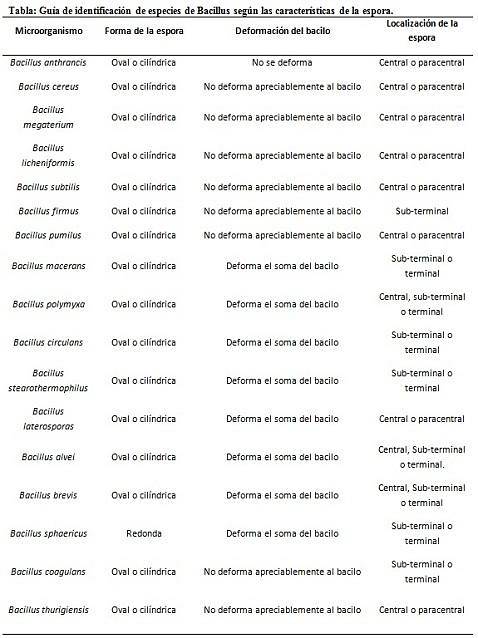
- Clostridium difficile vormt een ovale sporen in terminale positie die de bacil vervormt.
- De sporen van Clostridium tertium het is ovaal, vervormt de bacil niet en bevindt zich op het terminale niveau.
- De endospore van Clostridium tetani is terminaal en vervormt de bacil, waardoor het lijkt op een drumstick.
- Sporen van Clostridium botulinum, C. histolyticum, C. novy Y C. septicum ze zijn rond of ovaal subterminaal en vervormen de bacil.
- De endospore van Clostridium sordelli bevindt zich in de centrale positie, met een lichte vervorming.
Referenties
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Voorstel van een vereenvoudigde techniek voor het kleuren van bacteriële sporen zonder hittebestendige modificatie van de methode van Moeller toe te passen. Eur J Med Res.2007; 16 12 (8): 356-9.
- Wikipedia-bijdragers. Moeller vlek. Wikipedia, de gratis encyclopedie. 3 november 2018, 03:28 UTC. Beschikbaar op: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Laboratoriumhandleiding voor microbiologische technieken. Afdeling Basiswetenschappen Academie voor Microbiologie. Nationaal Polytechnisch Instituut.
- "Endospore." Wikipedia, de gratis encyclopedie. 25 februari 2018, 10:20 UTC. 10 januari 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J en medewerkers. (2006). Arbeidspersoneel van de autonome gemeenschap Extremadura. Specifieke agenda Deel IV. MAD Redactioneel. Sevilla-Spanje, pp 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Laboratoriumspecialist, Galicische gezondheidsdienst (SERGAS). Specifiek onderwerp agendavolume 2. Redactioneel MAD. Sevilla-Spanje, pp 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. (5e ed.). Argentinië, Redactie Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott Microbiologische diagnose. 12 ed. Argentinië. Redactioneel Panamericana S.A


Niemand heeft nog op dit artikel gereageerd.