
May Grünwald-Giemsa kleurt grondgedachte, techniek en gebruik

De Mei Grünwald-Giemsa vlek o Pappenheim is een differentiële kleurtechniek die Giemsa en May Grünwald-reagentia mengt. Het wordt gebruikt voor de differentiatie van normale en abnormale bloedcellen in uitstrijkjes van perifeer bloed en beenmerg, en voor het kleuren van histologische coupes en cytologische monsters..
Beide reagentia -Giemsa en May Grünwald- zijn afgeleid van Romanowsky-achtige kleuring, een techniek die is gebaseerd op de combinatie van zure en basische kleurstoffen..
Giemsa verbeterde de techniek door het mengsel van eosine, methyleenblauw en hun derivaten te stabiliseren met glycerol. In plaats daarvan gebruikt May Grünwald eosine en methyleenblauw, met methanol als oplosmiddel. Deze strategische combinatie heeft uitstekende resultaten opgeleverd.
Hoewel het in termen van de observatie van celmorfologie op een vergelijkbare manier werkt als de Giemsa- en Wright-kleuringen, verbetert deze techniek de vorige door de kleuring van de parasieten die malaria, de ziekte van Chagas, leishmaniasis en trichomoniasis veroorzaken, te verfijnen..
Bovendien is het een zeer nuttige techniek gebleken voor de cytologische studie van zaadvloeistof. Het onderscheidde zich niet alleen door de morfologische kenmerken van spermatozoa te tonen, maar ook door de differentiatie van leukocyten, epitheelcellen en spermatogenesecellen met grote efficiëntie mogelijk te maken..
Artikel index
- 1 Grondgedachte
- 1.1 Verscheidenheid aan kleurstoffen
- 2 Techniek
- 2.1 Materialen
- 2.2 Geconcentreerde May Grünwald-kleurstofoplossing
- 2.3 Geconcentreerde Giemsa-kleuring
- 2.4 Bereiding van bufferoplossing bij pH 7,2
- 2.5 Procedure voor het kleuren van bloed- of beenmerguitstrijkjes
- 2.6 Techniek voor het kleuren van uitstrijkjes van zaadvloeistof
- 2.7 Belangrijke specificaties
- 3 toepassingen
- 3.1 Vaginale cytologie
- 3.2 Spermastaal
- 4 referenties
Basis
De techniek volgt de basis van Romanowsky-kleuringen, waarbij zure kleurstoffen een selectieve affiniteit hebben voor basale cellulaire componenten en zure componenten basische vlekken aantrekken..
Op een andere manier uitgelegd: zowel celstructuren als kleurstoffen hebben positieve of negatieve elektrische ladingen; gelijke ladingen stoten elkaar af en verschillende ladingen trekken elkaar aan.
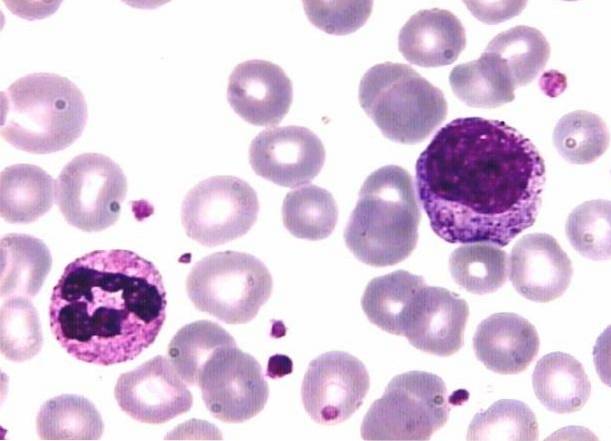
Basische kleurstoffen zoals methyleenblauw worden bijvoorbeeld positief geladen en aangetrokken door negatief geladen structuren. Daarom kleurt deze kleurstof kernen die rijk zijn aan DNA en RNA met negatief geladen fosfaatgroepen..
De korrels van gesegmenteerde basofielen en de cytoplasma's van mononucleaire witte bloedcellen die RNA bevatten, worden ook gekleurd..
Evenzo draagt de zure kleurstof een negatieve lading, daarom bindt deze zich aan positief geladen structuren zoals erytrocyten en korrels van gesegmenteerde eosinofielen. Wat betreft de korrels van de gesegmenteerde neutrofielen, deze fixeren beide kleurstoffen.
Verscheidenheid aan kleurstoffen
Bij deze techniek bestaat een combinatie van reacties tussen orthochromatische en metachromatische kleurstoffen. Orthochromatica (eosine en methyleenblauw) binden zich aan de celstructuur waarmee ze verband houden en zorgen voor een stabiele kleur die niet varieert.
Aan de andere kant variëren metachromatica (de derivaten van methyleenblauw azuur A en azuur B) hun oorspronkelijke kleur zodra ze aan de specifieke structuur zijn gehecht, en er kunnen zelfs verschillende tinten zijn.
Ten slotte vereist de stap die de May Grünwald-oplossing neemt de aanwezigheid van water, omdat zonder dit de kleurstof de structuren zal doordringen maar niet zal verharden. Om dit te laten gebeuren, moet de kleurstof polair worden of ioniseren, en dus kunnen neerslaan en zich kunnen binden aan verwante structuren..
Techniek
Materialen
- Microscoopglaasjes.
- Bruggen van kleuren.
- May-Grünwald-oplossing.
- Giemsa-vlek.
- Gedistilleerd water.
May Grünwald kleurstof geconcentreerde oplossing
0,25 g eosine-methyleenblauw (vlek volgens May Grünwald) moet worden afgewogen en opgelost in 100 ml methanol. Daarna wordt het preparaat 1 uur gemengd en 24 uur laten rusten. Als de tijd om is, lekt het.
Om de techniek toe te passen, moet de May Grünwald-kleurstof als volgt worden verdund: meet voor 200 ml verdunde kleurstof 30 ml van de geconcentreerde oplossing, voeg 20 ml bufferoplossing en 150 ml gedestilleerd water toe, ingesteld op pH 7,2-7,3. Later wordt het gemengd en gefilterd.
Giemsa-kleurconcentraat
0,5 g azuur-eosine-methyleenblauw (kleurstof volgens Giemsa) moet worden afgewogen, opgelost in 50 ml methanol en 50 ml glycerine toegevoegd aan het mengsel.
Om de techniek uit te voeren, wordt het 1:10 verdund met bufferoplossing en 10 minuten laten staan. Kan indien nodig worden gefilterd.
Bereiding van de bufferoplossing bij pH 7,2
Ze moeten worden gewogen:
- 40 mg kaliumdiwaterstoffosfaat (KH2PO4).
- 151 mg dinatriumwaterstoffosfaat 12-hydraat (Na2HPO4).
Beide verbindingen worden opgelost in 100 ml water.
Procedure voor het kleuren van bloed- of beenmerguitstrijkjes
Er zijn twee modi: een klassieker en een snel.
Klassieke modus
- Bedek de uitstrijkjes gedurende 2 tot 3 minuten met de verdunde May-Grünwald-oplossing..
- Was met gebufferd gedestilleerd water om de vorige oplossing te verwijderen.
- Dek af met dezelfde gebufferde wasoplossing en laat 1 minuut staan. Het idee is dat de vorige kleurstof aan de structuren wordt vastgemaakt en dat tegelijkertijd de cellen worden gehydrateerd.
- Voeg 12 druppels verdunde Giemsa-tinctuur toe aan het gebufferde water en blaas om te mengen en homogeniseer. Laat 15-20 minuten staan.
- Was de uitstrijkjes met gebufferd gedestilleerd water en laat ze aan de lucht drogen.
- Focus en observeer de gekleurde bloedcellen onder een lichtmicroscoop met behulp van de 40X-doelstelling. Indien nodig kan de 100X worden gebruikt.
Snelle modus
- Bedek het uitstrijkje gedurende 1 minuut met verdunde May Grünwald-beits..
- Was met gebufferd gedestilleerd water.
- Dek af met gebufferd water en laat 1 minuut staan.
- Plaats de verdunde Giemsa-vlek en laat 5 minuten staan.
- Was met gebufferd gedestilleerd water en laat aan de lucht drogen.
De hier beschreven technieken zijn een richtlijn, maar er moet rekening mee worden gehouden dat de procedures en kleuringstijden variëren naargelang het commerciële bedrijf dat de reagentia distribueert. Het is raadzaam om de stappen te volgen die strikt worden aangegeven door elk handelshuis.
Techniek voor het kleuren van uitstrijkjes van zaadvloeistof
1- Bedek het uitstrijkje gedurende 4 minuten met een dunne laag May Grünwald-oplossing.
2- Verwijder de kleurstof en was met gedestilleerd water.
3- Leg een laag verdunde Giemsa (1:10) 15 minuten in gedestilleerd water.
4- Verwijder de kleurstof en was met gedestilleerd water.
5- Laat drogen en observeer in de microscoop.
Belangrijke specificaties
De techniek vereist dat de reagentia en de wasoplossingen een pH hebben die is ingesteld op 7,2 -7,3, zodat de affiniteiten van de kleurstoffen voor de celstructuren niet worden verstoord en de verwachte uiteindelijke kleur niet varieert..
Toepassingen
Deze techniek wordt door klinische laboratoria gebruikt om uitstrijkjes van perifeer bloed en beenmerg, weefselcoupes en cytologieën te kleuren..
Op hematologisch gebied is deze techniek van vitaal belang bij de studie van afwijkingen van cellen in termen van vorm, grootte en aantal. Het is een zeer waardevol hulpmiddel voor de diagnose van bepaalde ziekten, zoals leukemie en bloedarmoede.
Bovendien is het van buitengewoon nut bij het zoeken naar parasieten in hematologische gebieden (Plasmodium sp Y Trypanosome cruzi) of histologisch (Leishmanias sp.
Vaginale cytologie
Met betrekking tot vaginale cytologie is deze techniek vooral voordelig voor de observatie van Trichomonas vaginalis. Dit is een belangrijke bevinding, aangezien de aanwezigheid ervan beelden van carcinoom simuleert. in situ die vervolgens verdwijnen wanneer de parasiet wordt verwijderd.
Spermastaal
Het is een ideaal hulpmiddel geweest voor de studie van spermastalen, omdat het waardevolle informatie geeft over de kwaliteit van het sperma.
De data die het biedt hebben vooral te maken met aantal en morfologie, maar ook met de daarbij aanwezige cellen die van levensbelang zijn, zoals kiemcellen, leukocyten en epitheelcellen..
Met deze analyse is het mogelijk om afwijkingen te beschrijven die zijn waargenomen in het sperma in het hoofd, de nek, het middenstuk en het hoofdgedeelte..
Bovendien kunnen ze ook helpen bij het aantonen van gevallen van hemospermie (aanwezigheid van rode bloedcellen in sperma) en leukospermie of piospermie (verhoogd aantal leukocyten in sperma).
Referenties
- Costamagna S, Prado M. Validatie van de verse test, May Grünwald-Giemsa en Gram-kleuringen en kweekmedia voor de diagnose van Trichomonas vaginalis. Parasitol. 2001; 25 (1-2): 60-64. Verkrijgbaar in: scielo.
- Merck KGaA-laboratorium. May Grünwald eosine methyleenblauw voor microscopie.
- "May-Grünwald-Giemsa-vlek." Wikipedia, de gratis encyclopedie. 15 november 2018, 14:37 UTC. 8 januari 2019, 04:29: en.wikipedia.org
- Glass Chemicals Panreac Laboratory. Reagentia voor histologische technieken, hematologie en microbiologie. Beschikbaar op: glasschemicals.com
- Retamales E, Manzo V. Aanbeveling voor het kleuren van bloeduitstrijkjes voor het aflezen van het hemogram. Nationaal en referentie biomedisch laboratorium. Instituut voor Volksgezondheid van Chili.
- Sarabia L. Spermiogram volgens WHO-criteria. Programma voor ontwikkelingsanatomie en biologie. Medische faculteit. Universiteit van Chili. Beschikbaar op: pp.centramerica.com


Niemand heeft nog op dit artikel gereageerd.