
Specifiek volume water, lucht, stoom, stikstof en ideaal gas
De specifiek volume het is een intensieve eigenschap die kenmerkend is voor elk element of materiaal. Het wordt wiskundig gedefinieerd als de relatie tussen het volume dat wordt ingenomen door een bepaalde hoeveelheid materie (een kilogram of een gram); met andere woorden, het is het omgekeerde van de dichtheid.
De dichtheid geeft aan hoeveel 1 ml materie weegt (vloeibaar, vast, gasvormig of een homogeen of heterogeen mengsel), terwijl het specifieke volume verwijst naar het volume dat 1 g (of 1 kg) ervan inneemt. Als u dus de dichtheid van een stof kent, volstaat het om het omgekeerde te berekenen om het specifieke volume te bepalen.

Waar verwijst het woord "specifiek" naar? Wanneer een eigenschap specifiek wordt genoemd, betekent dit dat deze wordt uitgedrukt als een functie van massa, waardoor deze kan worden getransformeerd van een uitgebreide eigenschap (die afhangt van massa) naar een intensieve eigenschap (continu op alle punten in het systeem)..
De eenheden waarin het specifieke volume normaal gesproken wordt uitgedrukt, zijn (m3/ Kg) of (cm3/ g). Hoewel deze eigenschap niet afhangt van de massa, hangt ze wel af van andere variabelen, zoals de temperatuur of druk die op de stof invalt. Hierdoor neemt een gram stof meer volume in bij hogere temperaturen..
Artikel index
- 1 Vanaf het water
- 2 Vanuit de lucht
- 3 Van stoom
- 4 Stikstof
- 5 Van het ideale gas
- 6 referenties
Van het water
In de eerste afbeelding zie je een druppel water die op het punt staat zich te vermengen met het oppervlak van de vloeistof. Omdat het van nature een substantie is, neemt zijn massa als elk ander volume in beslag. Dit macroscopische volume is het product van het volume en de interacties van zijn moleculen.
Het watermolecuul heeft de chemische formule HtweeOf met een molecuulmassa van ongeveer 18 g / mol. De dichtheden die het presenteert, zijn ook afhankelijk van de temperatuur, en op macroschaal wordt de verdeling van de moleculen als zo homogeen mogelijk beschouwd..
Met de dichtheidswaarden ρ bij een temperatuur T is het voldoende om de volgende formule toe te passen om het specifieke volume vloeibaar water te berekenen:
v = (1 / ρ)
Het wordt berekend door de dichtheid van het water experimenteel te bepalen met een pyknometer en vervolgens de wiskundige berekening uit te voeren. Omdat de moleculen van elke stof van elkaar verschillen, zal ook het resulterende specifieke volume verschillen.
Als de dichtheid van water over een breed temperatuurbereik 0,997 kg / m is3, het specifieke volume is 1003 m3/ kg.
Vanuit de lucht

Lucht is een homogeen gasmengsel, voornamelijk samengesteld uit stikstof (78%), gevolgd door zuurstof (21%) en tenslotte door andere gassen in de aardatmosfeer. De dichtheid is een macroscopische uitdrukking van al dat mengsel van moleculen, die niet efficiënt op elkaar inwerken en zich in alle richtingen voortplanten..
Omdat wordt aangenomen dat de stof continu is, verandert de verspreiding ervan in een container niet van samenstelling. Nogmaals, door de dichtheid te meten bij de beschreven omstandigheden van temperatuur en druk, is het mogelijk om te bepalen welk volume 1 g lucht inneemt.
Omdat het specifieke volume 1 / ρ is en de ρ kleiner is dan dat van water, is het specifieke volume groter.
De verklaring voor dit feit is gebaseerd op de moleculaire interacties van water versus lucht; de laatste, zelfs in het geval van vochtigheid, condenseert niet tenzij het wordt blootgesteld aan zeer koude temperaturen en hoge drukken.
Van stoom
Zal onder dezelfde omstandigheden een gram damp een groter volume innemen dan dat van een gram lucht? Lucht is dichter dan water in de gasfase, omdat het een mengsel is van bovengenoemde gassen, in tegenstelling tot watermoleculen..
Omdat het specifieke volume het omgekeerde is van de dichtheid, neemt een gram damp meer volume in (is minder dicht) dan een gram lucht.
De fysische eigenschappen van stoom als vloeistof zijn essentieel in veel industriële processen: onder andere warmtewisselaars in de binnenkant, om de vochtigheid te verhogen, schone machines..
Er zijn veel variabelen waarmee rekening moet worden gehouden bij het verwerken van grote hoeveelheden stoom binnen industrieën, vooral met betrekking tot de vloeistofmechanica..
Stikstof
Net als de rest van gassen hangt de dichtheid ervan sterk af van de druk (in tegenstelling tot vaste stoffen en vloeistoffen) en van de temperatuur. De waarden voor het specifieke volume variëren dus afhankelijk van deze variabelen. Vandaar de noodzaak om het specifieke volume te bepalen om het systeem uit te drukken in termen van intensieve eigenschappen.
Zonder experimentele waarden, door moleculaire redenering, is het moeilijk om de dichtheid van stikstof te vergelijken met die van andere gassen. Het stikstofmolecuul is lineair (N≡N) en dat van water is hoekig.
Omdat een 'lijn' minder volume inneemt dan een 'Boemerang”, Dan kan verwacht worden dat stikstof volgens de definitie van dichtheid (m / V) dichter is dan water. Met een dichtheid van 1.2506 kg / m3, het specifieke volume onder de omstandigheden waarin deze waarde werd gemeten, is 0,7996 m3/ Kg; het is gewoon het omgekeerde (1 / ρ).
Van het ideale gas
Het ideale gas is er een die voldoet aan de volgende vergelijking:
P = nRT / V
Het is duidelijk dat de vergelijking geen enkele variabele beschouwt, zoals moleculaire structuur of volume; noch wordt er gekeken naar hoe gasmoleculen met elkaar interageren in een ruimte die door het systeem wordt bepaald.
In een beperkt temperatuur- en drukbereik "gedragen" alle gassen zich hetzelfde; om deze reden is het tot op zekere hoogte geldig om aan te nemen dat ze voldoen aan de ideale gasvergelijking. Uit deze vergelijking kunnen dus verschillende eigenschappen van gassen worden bepaald, inclusief het specifieke volume.
Om het op te lossen, is het nodig om de vergelijking uit te drukken in termen van de dichtheidsvariabelen: massa en volume. De mollen worden weergegeven door n, en deze zijn het resultaat van het delen van de massa van het gas door zijn molecuulmassa (m / M).
Door de variabele massa m in de vergelijking te nemen, als deze wordt gedeeld door het volume, kan de dichtheid worden verkregen; vanaf hier is het voldoende om de dichtheid te wissen en vervolgens beide zijden van de vergelijking "om te draaien". Door dit te doen, wordt het specifieke volume uiteindelijk bepaald.
De onderstaande afbeelding illustreert elk van de stappen om tot de uiteindelijke uitdrukking van het specifieke volume van een ideaal gas te komen.
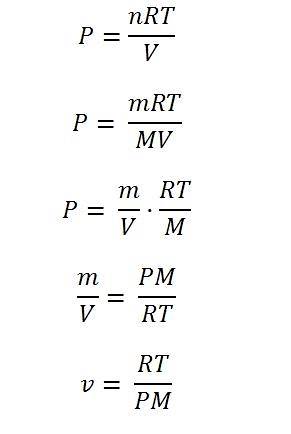
Referenties
- Wikipedia. (2018). Specifiek volume. Genomen uit: en.wikipedia.org
- Study.com. (21 augustus 2017). Wat is een specifiek volume? - Definitie, formule en eenheden overgenomen van: study.com
- POT. (5 mei 2015). Specifiek volume. Genomen uit: grc.nasa.gov
- Michael J. Moran en Howard N. Shapiro. (2004). Grondbeginselen van technische thermodynamica. (2e editie). Editorial Reverté, pagina 13.
- Unit 1: Concepten van thermodynamica. [Pdf]. Genomen uit: 4.tecnun.es
- TLV. (2018). Belangrijkste toepassingen voor stoom. Genomen van: tlv.com



Niemand heeft nog op dit artikel gereageerd.