
Ethyleenoxidestructuur, eigenschappen, risico's en toepassingen
De ethyleenoxide Het is een organische verbinding van de epoxidefamilie. Bij kamertemperatuur is het gasvormig, kleurloos en, hoewel het bijna reukloos is, heeft het een milde zoete geur, vergelijkbaar met die van ethers..
Het is een zeer veelzijdige chemische bouwsteen, omdat het wordt gebruikt in een breed scala aan industriële toepassingen voor de vervaardiging van andere chemische verbindingen met meerdere toepassingen. Dit komt door de hoge reactiviteit, dat wil zeggen, het gemak waarmee het met andere stoffen reageert..
Een van de belangrijkste toepassingen ervan is als grondstof bij de fabricage van antivriescomponenten voor autoradiatoren. De derivaten ervan worden gebruikt als ingrediënten in industriële of huishoudelijke reinigingsmiddelen, cosmetische producten en shampoos, weekmakers, farmaceutische preparaten of zalven..
Het is een veelgebruikt desinfectiemiddel, bijvoorbeeld bij de sterilisatie van medische en tandheelkundige apparatuur, omdat het in staat is virussen, bacteriën, schimmels en sporen te vernietigen, vooral in droge omstandigheden. Bovendien is het gebruikt om voedselproducten voor verpakking te ontsmetten, hoewel dit gebruik in twijfel wordt getrokken.
Ondanks zijn bruikbaarheid moet het met de grootste voorzichtigheid worden gehanteerd, aangezien het oog- en huidirritaties kan veroorzaken. Het langdurig inademen van ethyleenoxide kan het zenuwstelsel aantasten. Daarom moeten mensen die worden blootgesteld aan dampen of oplossingen beschermende uitrusting en kleding gebruiken..
Artikel index
- 1 Structuur
- 2 Eigenschappen
- 2.1 Andere namen
- 2.2 Fysieke toestand
- 2.3 Molecuulgewicht
- 2.4 Vlampunt
- 2.5 Dichtheid
- 2.6 Oplosbaarheid
- 2.7 Zelfontbrandingstemperatuur
- 2.8 Overige eigendommen
- 3 Productie
- 4 Risico's
- 4.1 Voor de gezondheid
- 4.2 Vuur
- 5 toepassingen
- 5.1 Industriële toepassingen
- 5.2 Medische toepassingen
- 5.3 Bibliotheken en musea
- 5.4 Landbouw en voedsel
- 6 referenties
Structuur
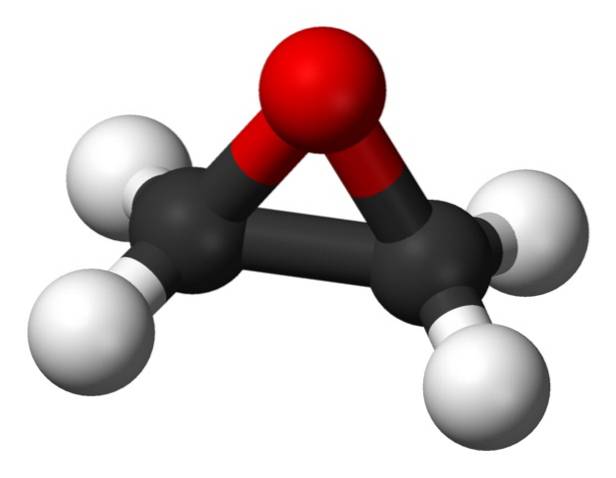
De moleculaire formule is CtweeH.4O. Het behoort tot de groep van epoxiden en is de eenvoudigste en belangrijkste hiervan. Het heeft de vorm van een drieledige ring.
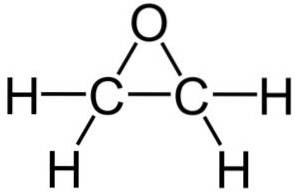
Vanwege de driehoekige ringstructuur is ethyleenoxide zeer reactief, wat te wijten is aan het gemak waarmee de ring opent. Gemiddeld zijn de bindingshoeken 60 °, waardoor uw bindingen zwak zijn. Het molecuul is minder stabiel dan dat van een lineaire ether en reageert gemakkelijk met andere chemische verbindingen..
Eigendommen
Andere namen
- Oxirano.
- Epoxyethaan.
Fysieke toestand
Bij kamertemperatuur en onder atmosferische druk is het een gas. Beneden 10,6 ºC en onder atmosferische druk is het een vloeistof. Onder -111 ºC is het een vaste stof.
Molecuulgewicht
44,05 g / mol.
Vlampunt
Minder dan 0 ºF (-17,8 ºC).
Dichtheid
De dichtheid is lager dan die van water, namelijk 0,882 bij 10 ºC. De dampen zijn op hun beurt zwaarder dan lucht.
Oplosbaarheid
Het is oplosbaar in water, benzeen, aceton, ethanol en ether. Het is mengbaar met tetrachloorkoolstof.
Zelfontbranding temperatuur
428,9 ºC.
Andere eigenschappen
- Als het wordt blootgesteld aan verhitting of vervuiling, kan het exotherm polymeriseren (waarbij grote hoeveelheden warmte worden geproduceerd). Als polymerisatie plaatsvindt in een container, kan deze hevig scheuren.
- Kan reageren met oxyderende stoffen.
- Het is extreem giftig, kankerverwekkend en een goede generator van mutaties in bacteriën en zoogdiercellen..
Productie
Op industriële schaal wordt het bereid door ethyleen te oxideren met zuurstof (Otwee) uit de lucht. De snelheid van deze reactie neemt toe met de aanwezigheid van zilvermetaal (Ag) en de inwerking van temperatuur. De reactie is hieronder weergegeven:
Ag, 250 ° C
2 CtweeH.4 + OFtwee -> 2CtweeH.4OF
Ethyleen Ethyleenoxide
Risico's
Voor de gezondheid
- Er is gemeld dat het neurologische aandoeningen veroorzaakt en de dood kan veroorzaken. De laagste concentratie die toxische effecten kan veroorzaken bij inademing is 12.500 ppm / 10 seconden (ppm betekent: deeltjes per miljoen).
- Het is sterk irriterend voor de huid, ogen en luchtwegen..
- Blootstelling aan ethyleenoxidedampen met een hoge concentratie kan oogirritatie, ontsteking van het oogmembraan en hoornvliesbeschadiging veroorzaken..
- De ontwikkeling van cataract is in verband gebracht met blootstelling aan de dampen en spatten ervan. Geconcentreerde oplossingen veroorzaken ernstig oogletsel.
- Contact van waterige oplossingen van ethyleenoxide met de huid veroorzaakt irritatie en kan leiden tot ernstige dermatitis met blaren en brandwonden..
- Inademing kan het zenuwstelsel aantasten en onder andere hoofdpijn en misselijkheid veroorzaken..
Brand
- Bij blootstelling aan vuur of hitte bestaat explosiegevaar. Bij verhitting komen gevaarlijke dampen vrij.
- Damp vormt explosieve mengsels met lucht in een groot aantal concentraties.
- Gebruik het apparaat niet met apparatuur die metalen zoals koper, zilver, kwik, magnesium, aluminium of ijzeroxiden bevat, en vermijd middelen zoals ammoniak, oxidatiemiddelen, organische zuren of basen, onder andere. Al deze materialen kunnen hun polymerisatie en / of explosie versnellen.
Toepassingen
Industriële toepassingen
Het wordt gebruikt als tussenpersoon bij de productie van andere chemicaliën, die op hun beurt worden gebruikt bij de vervaardiging van polyestervezels voor kleding, stoffering, tapijten en kussens..
Ethyleenoxide produceert de ethyleenglycol die wordt gebruikt in antivries van motorvoertuigen. Ethyleenglycol wordt ook gebruikt bij de vervaardiging van glasvezel en plastic verpakkingsfolies..
Andere chemicaliën die uit ethyleenoxide worden geproduceerd, zijn onder meer niet-ionische oppervlakteactieve stoffen die worden gebruikt in wasmiddelen en vaatwasmiddelen..
Medische toepassingen
Het wordt gebruikt als sterilisatiemiddel voor medische apparatuur, zoals chirurgische instrumenten, naalden en onderhuidse injectoren of prothesen.
Het wordt ook gebruikt voor het steriliseren van onder meer hemodialysemachines, laboratoriumapparatuur, tandheelkundige instrumenten, veterinaire instrumenten, thermometers, chirurgische kleding of EHBO-apparatuur..

Hoewel er verschillende methoden beschikbaar zijn voor de sterilisatie van medische apparatuur, kan bij sommige toepassingen geen beschikbare behandeling ethyleenoxide vervangen..
Dit is het geval bij de sterilisatie van bepaalde materialen die gevoelig zijn voor warmte en straling, evenals bij sommige instrumenten en apparaten die op de plaats van gebruik in ziekenhuizen moeten worden gesteriliseerd..
Bibliotheken en musea
Op deze plaatsen wordt ethyleenoxide gebruikt om ongedierte zoals schimmels en insecten te bestrijden. Dit gebruik komt echter niet zo vaak voor en wordt gebruikt wanneer andere alternatieven niet effectief zijn..
Landbouw en voedsel
Het is onder meer gebruikt als pesticide, fungicide, ontsmettingsmiddel, herbicide, insecticide, rodenticide. Vermindert aanzienlijk de populatie bacteriën en schimmels in kruiden.
Vanwege veiligheids- en milieuoverwegingen is het gebruik van ethyleenoxide voor het begassen van voedsel echter verboden in de Europese Unie en in de Verenigde Staten..
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Ethyleenoxide. Opgehaald van pubchem.ncbi.nlm.nih.gov
- Feiten over chemische veiligheid. (2019). Ethyleenoxide. Opgehaald van chemicalafetyfacts.org
- Morrison, Robert Thornton; en Boyd, Robert Neilson. 1992. Organic Chemistry. Prentice-Hall.
- Moerman, F. en Mager, K. (2016). Reiniging en desinfectie in faciliteiten voor de verwerking van droge voedingsmiddelen. In Handbook of Hygiene Control in the Food Industry (Second Edition). Opgehaald van sciendirect.com.
- Eastmond, David A. en Balakrishnan, Sharada. (2010). Genotoxiciteit van pesticiden. In Hayes 'Handbook of Pesticide Toxicology (derde editie). Opgehaald van sciencedirect.com
- Atungulu, G.G. en Pan, Z. (2012). Microbiële ontsmetting van noten en kruiden. Bij microbiële decontaminatie in de voedingsindustrie. Opgehaald van sciencedirect.com



Niemand heeft nog op dit artikel gereageerd.