
Fosforoxide (v) structuur, eigenschappen, verkrijging, gebruik, risico's

De fosforoxide (v) Het is een anorganische vaste stof gevormd door fosfor (P) en zuurstof (O). De empirische formule is PtweeOF5, terwijl de juiste moleculaire formule P is4OF10. Het is een zeer hygroscopische witte vaste stof, dat wil zeggen dat het heel gemakkelijk water uit de lucht kan opnemen en er onmiddellijk mee kan reageren. De reactie kan gevaarlijk zijn omdat het een snelle temperatuurstijging veroorzaakt.
De sterke neiging om water te absorberen heeft ervoor gezorgd dat het werd gebruikt als droogmiddel in chemische laboratoria, evenals als dehydrator van sommige verbindingen, dat wil zeggen om water uit zijn moleculen te verwijderen..

Fosforoxide (v) wordt ook gebruikt om de bindingsreacties van verschillende koolwaterstofmoleculen te versnellen, een reactie die condensatie wordt genoemd. Bovendien kunnen bepaalde organische zuren in esters worden omgezet.
Het is bijvoorbeeld gebruikt om benzine te raffineren, om fosforzuur H te bereiden3PO4, om verbindingen te verkrijgen die dienen om brand te vertragen, om glas te maken voor vacuümtoepassingen, en vele andere toepassingen.
Fosforoxide (v) moet in goed gesloten containers worden bewaard om te voorkomen dat het in contact komt met vocht in de lucht. Het is bijtend en kan ogen, huid en slijmvliezen beschadigen..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Sublimatietemperatuur
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3.7 Chemische eigenschappen
- 3.8 Overige eigenschappen
- 4 Verkrijgen
- 4.1 Aanwezigheid in de natuur
- 5 toepassingen
- 5.1 Als ontwaterings- en droogmiddel
- 5.2 In organische chemische reacties
- 5.3 Bij het raffineren van brandstof
- 5.4 In verschillende toepassingen
- 6 Risico's
- 7 referenties
Structuur
Fosforoxide (v) bestaat uit fosfor (P) en zuurstof (O), waarbij fosfor een valentie heeft van +5 en zuurstof -2. Het fosforoxidemolecuul (v) heeft vier fosfor- en tien zuurstofatomen en daarom is de juiste molecuulformule P4OF10.
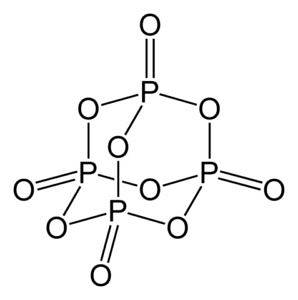
Het bestaat in drie kristallijne vormen, als amorf poeder en in glasvorm (als glas). In de hexagonale kristallijne vorm wordt elk van de fosforatomen gevonden op de hoekpunten van een tetraëder..
Nomenclatuur
- Fosforoxide (v)
- Fosforpentoxide
- Difosforpentoxide
- Fosforpentoxide
- Fosforzuuranhydride
- Tetrafosfor-decaoxide
Eigendommen
Fysieke toestand
Kristallijne witte vaste stof. De meest voorkomende vorm is die van hexagonale kristallen.
Molecuulgewicht
283,89 g / mol
Smeltpunt
562 ºC
Sublimatietemperatuur
360 ºC bij 1 atmosfeer druk. Het betekent dat het bij deze temperatuur van vast naar gas gaat zonder door de vloeibare toestand te gaan.
Dichtheid
2,30 g / cm3
Oplosbaarheid
Zeer goed oplosbaar in water. Oplosbaar in zwavelzuur. Onoplosbaar in aceton en ammoniak.
Chemische eigenschappen
Fosforoxide (v) absorbeert en reageert extreem snel met water in de lucht, waarbij fosforzuur H wordt gevormd3PO4. Deze reactie is exotherm, wat betekent dat er tijdens de reactie warmte wordt geproduceerd..
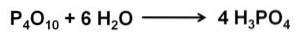
De reactie van P4OF10 met water leidt tot de vorming van een mengsel van fosforzuren waarvan de samenstelling afhangt van de hoeveelheid water en de omstandigheden.
De reactie met alcoholen leidt tot de vorming van esters van fosforzuur of van polymere zuren, afhankelijk van de experimentele omstandigheden..
P.4OF10 + 6 ROH → 2 (RO)tweePO.OH + 2 RO.PO (OH)twee
Met basische oxiden vormt het vaste fosfaten.
Het is bijtend. Kan gevaarlijk reageren met mierenzuur en anorganische basen zoals natriumhydroxide (NaOH), calciumoxide (CaO) of natriumcarbonaat NatweeCO3.
Als u een oplossing van perchloorzuur HClO giet4 en chloroform CHCl3 in fosforoxide (v) P4OF10 er vindt een gewelddadige explosie plaats.
Andere eigenschappen
Het is niet brandbaar. Het bevordert de verbranding niet. De reactie met water is echter zo heftig en exotherm dat er brandgevaar bestaat..
Het verkrijgen van
Het kan worden bereid door directe oxidatie van fosfor in een stroom droge lucht. Fosfor oxideert wanneer het in contact komt met overtollige zuurstof en vormt fosforoxide (v).
P.4 + 5 Otwee → Blz4OF10
Aanwezigheid in de natuur
Fosfor (v) oxide wordt aangetroffen in mineralen zoals ilmeniet, rutiel en zirkoon.
Ilmeniet is een mineraal dat ijzer en titanium bevat en soms fosfor (v) oxide bevat in concentraties die variëren tussen 0,04 en 0,33 gewichtsprocent. Rutiel is een titaanoxidemineraal en kan ongeveer 0,02 gew.% P bevattentweeOF5.
Zirkoonzanden (een mineraal van het element zirkonium) hebben fosforoxide (v) in 0,05-0,39 gewichtsprocent.
Toepassingen
Als dehydratatie- en droogmiddel
Vanwege zijn grote hebzucht naar water is het een van de bekendste dehydratatiemiddelen en zeer effectief bij temperaturen onder 100 ° C..
Het kan water onttrekken aan stoffen die zelf als dehydratatiemiddelen worden beschouwd. U kunt bijvoorbeeld water uit zwavelzuur H verwijderentweeSW4 veranderen in SO3 en salpeterzuur HNO3 veranderen in NtweeOF5.

In principe kan het al die vloeistoffen en gassen waarmee het niet reageert, drogen, zodat het sporen van vocht uit vacuümsystemen kan verwijderen.
In organische chemische reacties
Fosforoxide (v) dient om ringen van organische verbindingen en andere condensatiereacties te sluiten.
Het maakt het mogelijk organische zuren te veresteren met de mogelijkheid onderscheid te maken tussen primaire alifatische carbonzuren (koolstofketen zonder ringen met de -COOH-groep aan het ene uiteinde) en aromatische zuren (-COOH-groep gehecht aan de benzeenring), aangezien deze laatste niet reageren.
Het dient ook om een molecuul H te verwijderentweeO van de amiden R (C = O) NHtwee en zet ze om in R-CN-nitrilen. Bovendien katalyseert of versnelt het de oxygenatie-, dehydrogenerings- en polymerisatiereacties van bitumen.

Bij het raffineren van brandstof
Sinds de jaren 30 van de 20e eeuw hebben bepaalde onderzoeken aangetoond dat fosfor (v) oxide een verfijnende werking op benzine uitoefende, waardoor het octaangetal toenam..
De verfijnende werking van P4OF10 het is voornamelijk te wijten aan condensatiereacties (vereniging van verschillende moleculen) en niet polymerisatie (vereniging van gelijke moleculen).
De P4OF10 versnelt de directe alkylering van aromatische koolwaterstoffen met olefinen, de omzetting van olefinen in naftenen en hun gedeeltelijke polymerisatie. De alkyleringsreactie verhoogt het octaangetal van benzine.
Op deze manier wordt een geraffineerde benzine van hoge kwaliteit verkregen.

In verschillende toepassingen
Fosforoxide (v) wordt gebruikt om:
- Bereid fosforzuur H3PO4
- Verkrijg acrylaatesters en oppervlakteactieve stoffen
- Bereid fosfaatesters voor die worden gebruikt als vlamvertragers, oplosmiddelen en verdunningsmiddelen
- Omzetting van fosfortrichloride in fosforoxychloride
- Laboratorium reagens
- Vervaardiging van speciaal glas voor vacuümbuizen
- Verhoog het smeltpunt van asfalt
- Dienen als een standaardmolecuul bij de bepaling van fosfor of fosfaten in fosfaatgesteente, meststoffen en portlandcement, in de vorm van PtweeOF5
- Verbeter de bindingen tussen bepaalde polymeren en de ivoren laag die tanden hebben

Risico's
Fosfor (v) oxide moet in afgesloten containers en op koele, droge, goed geventileerde plaatsen worden bewaard.
Dit dient om te voorkomen dat het in contact komt met water, omdat het er heftig mee kan reageren en veel warmte kan genereren, zodat het nabijgelegen materialen verbrandt die brandbaar zijn..
Fosfor (v) oxidestof is irriterend voor de ogen en de luchtwegen en bijtend voor de huid. Kan brandwonden aan de ogen veroorzaken. Inslikken veroorzaakt fatale interne brandwonden.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Fosforzuuranhydride. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Nayler, P. (2001). Bitumens: gewijzigd. Chemische modificatie. In Encyclopedia of Materials: Science and Technology. Opgehaald van sciencedirect.com.
- Malishev, B.W. (1936). Fosforpentoxide als raffinagemiddel voor benzine. Industrial & Engineering Chemistry 1936, 28, 2, 190-193. Opgehaald van pubs.acs.org.
- Epps, Jr. E.A. (1950). Fotometrische bepaling van beschikbaar fosforpentoxide in meststoffen. Analytical Chemistry 1950, 22, 8, 1062-1063. Opgehaald van pubs.acs.org.
- Banerjee, A. et al. (1983). Gebruik van fosforpentoxide: verestering van organische zuren. J. Org. Chem. 1983, 48, 3108-3109. Opgehaald van pubs.acs.org.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Vierde druk. John Wiley & Sons.
- Ogliari, F.A. et al. (2008). Synthese van fosfaatmonomeren en binding aan dentine: veresteringsmethoden en gebruik van fosforpentoxide. Journal of Dentistry, jaargang 36, nummer 3, maart 2008, pagina's 171-177. Opgehaald van sciencedirect.com.



Niemand heeft nog op dit artikel gereageerd.