
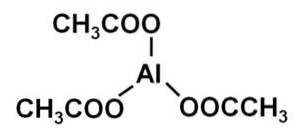
Aluminiumacetaat (Al (CH3COO) 3) structuur, eigenschappen, gebruik

De aluminium acetaat is een organische verbinding gevormd door een aluminiumion Al3+ en drie acetaationen CH3COO-. De chemische formule is Al (CH3COO)3. Het is ook bekend als aluminiumtriacetaat. Het is een licht hygroscopische witte vaste stof en oplosbaar in water..
Om deze verbinding te verkrijgen, moeten volledig watervrije omstandigheden worden gebruikt, dat wil zeggen vrij van water, anders moet het aluminiumdiacetaat Al (OH) (CH3COO)twee.
Aluminiumacetaatoplossingen hebben antibacteriële en schimmelwerende eigenschappen, daarom worden ze sinds de 19e eeuw gebruikt om infecties, met name van de oren, te behandelen..
De bekendste is de oplossing van Burow, bedacht door een Duitse arts. Het gebruik ervan heeft echter af en toe geleid tot schade aan het middenoor..
Deze oplossing is ook gebruikt om huidproblemen zoals jeuk en huiduitslag te behandelen. Het wordt zelfs gebruikt als zonnebrandverlichter.
Aluminiumacetaat en zijn derivaten worden gebruikt om zeer kleine structuren of deeltjes aluminiumoxide Al te verkrijgentweeOF3. Deze structuren of nanodeeltjes kunnen de vorm hebben van bladeren, bloemen of nanobuisjes..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Oplosbaarheid
- 3.4 Chemische eigenschappen
- 3.5 Overige eigenschappen
- 4 Verkrijgen
- 5 Gebruikt in de geneeskunde
- 5.1 Oorontstekingen
- 5.2 Huidziekten
- 6 Andere toepassingen
- 6.1 Beëindigd gebruik
- 7 Schadelijke effecten
- 8 referenties
Structuur
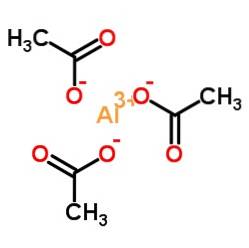
Aluminiumtriacetaat bestaat uit een aluminiumkation Al3+ en drie acetaatanionen CH3COO-. Het is het aluminiumzout van azijnzuur CH3COOH.
Aluminium wordt via hun zuurstof gebonden aan acetaatanionen. Met andere woorden, het is gehecht aan drie zuurstofatomen. Deze knooppunten zijn ionisch.
Nomenclatuur
- Aluminiumacetaat
- Aluminiumtriacetaat
- Aluminium ethanoaat
- Burow's oplossing (vertaling uit het Engels Burow's oplossing): Het is een oplossing van aluminiumacetaat.
Eigendommen
Fysieke toestand
Effen wit.
Molecuulgewicht
204,11 g / mol
Oplosbaarheid
Oplosbaar in water.
Chemische eigenschappen
In waterige oplossing wordt aluminiumtriacetaat opgelost en heeft de neiging om diacetaat Al (OH) (CH3COO) en soms Al (OH) monoacetaattwee(CH3COO). Het hangt allemaal af van de pH en de hoeveelheid azijnzuur CH3COOH aanwezig in de oplossing.
Al (CH3COO)3 + H.tweeO ⇔ Al (OH) (CH3COO)twee + CH3COOH
Al (CH3COO)3 + 2 uurtweeO ⇔ Al (OH)twee(CH3COO) + 2 CH3COOH
Andere eigenschappen
Aluminiumacetaat is enigszins hygroscopisch, dat wil zeggen dat het de neiging heeft om water uit de lucht op te nemen.
Het verkrijgen van
Aluminiumacetaat wordt bij voorkeur verkregen onder strikt watervrije omstandigheden, dat wil zeggen in totale afwezigheid van water. Dit omvat ook de afwezigheid van lucht, omdat deze vocht kan bevatten..
Verhit een mengsel van ijsazijnzuur CH3COOH en azijnzuuranhydride (CH3CO)tweeOf onder zodanige omstandigheden dat al het aanwezige water kan worden verwijderd. Aan dit hete mengsel wordt aluminiumchloride AlCl toegevoegd.3 watervrije vaste stof (zonder water).
Een witte vaste stof van Al (CH3COO)3.
AlCl3 + 3 CH3COOH → Al (CH3COO)3 + 3 HCl
De totale afwezigheid van water is belangrijk om de vorming van zouten van aluminiummonoacetaat Al (OH) te voorkomentwee(CH3COO) en aluminiumdiacetaat Al (OH) (CH3COO)twee.
Het kan ook worden verkregen door de reactie van aluminiumhydroxide Al (OH)3 en azijnzuur CH3COOH.
Gebruikt in de geneeskunde
Oor infecties
Aluminiumacetaat wordt sinds de 19e eeuw gebruikt om otitis te behandelen, een ontsteking van het buiten- of middenoor die meestal gepaard gaat met een infectie. Het gebruik ervan is te wijten aan het antibacteriële en schimmelwerende effect.
Het is gebruikt in de vorm van een 13% aluminiumacetaatoplossing, oorspronkelijk bedacht door de Duitse arts Karl August von Burow, daarom wordt het Burow's oplossing genoemd..
Gebleken is dat het de groei remt van micro-organismen die gewoonlijk worden aangetroffen in otitis media of externa, zoals otitis media. Pseudomonas aeruginosa, de Staphylococcus aureus en de Proteus mirabilis.

Er zijn echter mensen die melden dat deze oplossingen schadelijk kunnen zijn voor het oor. Sommige dierstudies onderzoeken de toxische effecten op het oor, maar hebben tegenstrijdige resultaten gerapporteerd..
Bepaalde onderzoekers raden aan om geen aluminiumacetaat te gebruiken wanneer het trommelvlies is geperforeerd, omdat is waargenomen dat het een ontstekingseffect heeft op het middenoor..
Huidziektes
De oplossing van Burow wordt gebruikt als een antiseptisch, samentrekkend middel en als een actuele oplossing voor de behandeling van ernstige huiduitslag, dermatitis, ontsteking, jeuk, verbranding en zonnebrand. Heeft een kalmerend en irritatieverlagend effect.
Andere gebruiken
Aluminiumtriacetaat en zijn derivaten worden gebruikt voor veel kwalitatieve en kwantitatieve chemische experimenten.
Een derivaat van aluminiumtriacetaat, Al (OH) (CH3COO)twee ook wel aluminiumhydroxide-acetaat genoemd, het wordt gebruikt als een voorloper om nanostructuren van gamma-aluminiumoxide (γ-AltweeOF3.
In dit geval betekent precursor dat de γ-Al-nanostructuren worden bereid uit aluminiumdiacetaat (op een bepaalde manier verkregen).tweeOF3, en dit wordt bereikt door het tot zeer hoge temperaturen te verhitten.
Nanostructuren zijn zeer kleine deeltjes die alleen kunnen worden waargenomen met speciale microscopen zoals elektronenmicroscopen. Met aluminiumacetaat als voorloper zijn γ-Al nanostructuren verkregentweeOF3 vergelijkbaar met bladeren, bloemen, vezels en zelfs nanobuisjes.

Beëindigd gebruik
Aan het begin van de 20e eeuw werd aluminiumacetaat gebruikt als conserveermiddel in voedingsmiddelen zoals worst in blik.
Een aluminiumacetaatoplossing werd bereid door aluminiumsulfaat Al te mengentwee(ZW43, calciumcarbonaat CaCO3, azijnzuur CH3COOH en water HtweeOf, en het werd aan het voedsel toegevoegd.
Wanneer deze oplossing in contact komt met het vlees, wordt het aluminium in zijn bestanddelen gefixeerd in de vorm van een verbinding die onoplosbaar is in kokend water, maar die ongeveer 80% in maagsap oplost..
Al in 1904 was bekend dat aluminiumzouten de spijsvertering vertragen, zowel in de maag als in de darmen. Daarom is het ongewenst om aluminiumacetaatoplossingen aan ingeblikt voedsel toe te voegen..

Schadelijke effecten
Aangezien er onderzoeken zijn die melden dat aluminiumacetaat giftig kan zijn, zijn er tests uitgevoerd waarbij laboratoriummuizen zijn geïnjecteerd met aluminiumacetaat.
De resultaten geven aan dat deze verbinding zowel schade aan de wervelkolom van genoemde dieren als schade aan de chromosomen en het sperma van de dieren veroorzaakt. Met andere woorden, het is genotoxisch.
Dit maakt u attent op de mogelijke gezondheidsrisico's die kunnen worden veroorzaakt door overmatige blootstelling aan aluminiumacetaat en op de voorzichtigheid die moet worden betracht bij het gebruik ervan..
Referenties
- Mac-Kay Chace, E. (1904). Het gebruik van basisaluminiumacetaat als conserveermiddel in worst. Journal of the American Chemical Society 1904, 26, 6: 662-665. Opgehaald van pubs.acs.org.
- Hood, G.C. en Ihde, A.J. (1950). Aluminiumacetaten en propionaten - hun bereiding en samenstelling. Journal of the American Chemical Society 1950, 72, 5: 2094-2095. Opgehaald van pubs.acs.org.
- Pitaro, J. et al .; (2013). Ototoxiciteit van aluminiumacetaat / benzeenethoniumchloride otica-oplossing in het Chinchilla-diermodel. Laryngoscoop, 2013; 123 (10): 2521-5. Opgehaald van ncbi.nlm.nih.gov.
- Thorp, M.A. et al. (2000). Burow's oplossing bij de behandeling van actieve mucosale chronische etterende otitis media: het bepalen van een effectieve verdunning. The Journal of Laryngology & Otology, juni 2000, deel 114, blz. 432-436. Opgehaald van ncbi.nlm.nih.gov.
- D'Souza, de heer P. et al. (2014). Beoordeling van genotoxiciteit van aluminiumacetaat in beenmerg, mannelijke geslachtscellen en foetale levercellen van Zwitserse albinomuizen. Mutation Research 766 (2014) 16-22. Opgehaald van ncbi.nlm.nih.gov.
- Basal, Y. et al. (2015). De effecten van actuele oplossingen van Burow en Castellani op het middenoorslijmvlies van ratten. J. Int Adv Otol 2015; 11 (3): 253-6. Opgehaald van advancedotology.org.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Aluminiumacetaat. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Buttaravoli, P. en Leffler, S.M. (2012). Zonnebrand. Wat moeten we doen. In kleine noodgevallen (derde editie). Opgehaald van sciencedirect.com.
- Thompson, E. en Kalus, A. (2017). Acute huidreacties en bacteriële infecties. Behandeling. In The Travel and Tropical Medicine Manual (vijfde editie). Opgehaald van sciencedirect.com.
- Kim, T. et al. (2010). Morfologie Controleerbare synthese van gamma-aluminiumoxide nanostructuren via een Ionische vloeistofondersteunde hydrothermische route. Crystal Growth & Design, Vol. 10, nr. 7, 2010, blz. 2928-2933. Opgehaald van pubs.acs.org.
- Rajala, J.W. et al. (2015). Core-Shell Electrospun holle aluminiumoxide keramische vezels. Vezels 2015, 3, 450-462. Opgehaald van mdpi.com.



Niemand heeft nog op dit artikel gereageerd.